1、选择题 下列溶液中Cl-离子浓度最大的是
A.65mL 1mol/L的KCl溶液
B.25mL 3mol/L的NaCl溶液
C.20mL 2mol/L的MgCl2溶液
D.10mL 1.5mol/L的AlCl3溶液
参考答案:D
本题解析:根据化合物的化学式可知,四种溶液只氯离子的浓度分别是(mol/L)1、3、2×2=4、1.5×3=4.5,答案选D。
点评:该题是常识性试题的考查,难度不大。该题的关键是明确电解质电离出的氯离子个数,另外还需要注意审题,即要求计算的是浓度,还是物质的量。因为物质的量的计算需要考虑溶液的体积。
本题难度:一般
2、填空题 硝酸具有强的氧化性,并且浓度不同,氧化能力也不同。
(1)质量分数为63%,密度为?1.5?g·cm-3的浓硝酸,其物质的量浓度为___________。
(2)某学习小组为比较浓、稀硝酸分别与铜反应的不同,需配制100mL?3?mol·L-1稀硝酸,他们需要量取上述浓硝酸___________mL;如下图所示仪器,在配制过程中不需用到的是_____________(填序号)。 ? ?
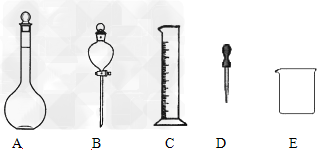
除图中已有的仪器外,配制上述溶液还需用到的玻璃仪器是__________;
参考答案:(1)15?mol·L-1?
(2)20.0mL;B;玻璃棒
本题解析:
本题难度:一般
3、选择题 现需要物质的量浓度约为2mol?L-1的NaOH溶液100mL,下面的操作正确的是( )
A.称取7.8gNa2O2固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL5mol?L-1NaOH溶液,倒入250mL烧杯中,再用另一量筒量取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
参考答案:A、m=n?M=C?V?M=2mol?L-1×0.1L×40g/mol=8g,称取7.8gNaOH固体,氢氧化钠的质量不足,配制的溶液浓度小于2mol/L,故A错误;
B、量筒只能用来量取液体,不能用来溶解固体,故B错误;
C、容量瓶只能用来配制溶液,不能用来稀释或溶解药品,故C错误;
D、100mL 2mol?L-1 的NaOH溶液含有氢氧化钠的物质的量是0.2mol,40mL 5mol?L-1的NaOH溶液含有氢氧化钠的物质的量是0.2mol,两种溶液溶质的物质的量相等,所以能配制物质的量浓度约为2mol?L-1 NaOH溶液100mL,故D正确;
故选:D.
本题解析:
本题难度:一般
4、选择题 标准状况时的一定物质的量的某气体体积一般比通常状况时要小,其原因是标准状况时比通常状况时的()
A.压强大
B.温度高
C.压强小
D.温度低
参考答案:D
本题解析:标准状况与通常状况的差别在于二者的温度不同。在其他条件一定的前提下,温度越高,气体的体积也就越大。
本题难度:简单
5、选择题 下列关于溶液物质的量浓度的说法正确的是
A.把1molNaCl溶于1L水中所得溶液的物质的量浓度为1mol/L
B.实验室配制500mL 0.1mol/L的CuSO4溶液,需称取胆矾12.5g
C.1L水中溶解224 L HCl气体(标准状况下测得)后形成溶液物质的量浓度为10 mol·L1
D.将7.4克氢氧化钙放入烧杯中,加水搅拌冷却后全部转移到100 mL容量瓶并加水至刻度线,浓度为1 mol·L-1