1、填空题 A、B、C、D、E、F六种短周期元素,原子序数依次增大。A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。D元素原子最外层电子数是次外层电子数的一半。回答下列问题:
(1) 写出元素D基态原子的电子排布图:?;
(2)用电子式表示B、F两元素形成化合物的过程:?;
(3)A的气态氢化物的沸点?(填“高于”、“低于”)E的气态氢化物的稳定性;原因是:?。
参考答案:
(1)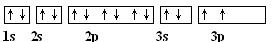 (2分)
(2分)
(2)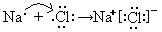 ?(2分)
?(2分)
(3)高于 ,形成分子间氢键 (2分)
本题解析:略
本题难度:一般
2、选择题 下列说法中正确的是:
A.在周期表中,主族元素所在的族序数等于原子核外电子数
B.最外层电子数为8的不一定是稀有气体元素的原子
C.元素的原子序数越大,其原子半径越大
D.键能越大 ,表示该分子越容易受热分解
,表示该分子越容易受热分解
参考答案:D
本题解析:略
本题难度:简单
3、选择题 已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列系正确的是
A.离子的还原性:Y2->Z-
B.质子数:c>b
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
参考答案:A
本题解析:略
本题难度:简单
4、选择题 A、B表示两种不同质子数的原子。A原子的最外电子层上只有1个电子,B原子的最外电子层上有6个电子,当A、B两种原子相互结合时,构成化合物的化学式可表示为(?)
A.A2B? B.AB? C.AB2? D.A2B3
参考答案:A
本题解析:A原子的最外电子层上只有1个电子,则A是第IA,最高价是+1价。B原子的最外电子层上有6个电子,因此B是第ⅥA,最低价是-2价。所以当A、B两种原子相互结合时,构成化合物的化学式可表示为A2B,答案选A。
本题难度:简单
5、填空题 下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
?主族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
?2
| ?
| ?
| ?
| ①
| ②
| ③
| ?
| ?
|
?3
| ④
| ?
| ⑤
| ?
| ?
| ⑥
| ⑦
| ⑧
|
?4
| ⑨
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
(1)在这些元素中,化学性质最不活泼的是:?(填具体化学用语,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是?,碱性最强的化合物的电子式是:?。
(3)最高价氧化物是两性氧化物的元素是?;写出它的氧化物与氢氧化钠反应的离子方程式?。
(4)②氢化物与③的单质在一定条件下反应的化学方程式为:?。
(5) ②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因?。
(6) 用结构式表示元素①与③形成的化合物 ?,该化合物在固体时俗称?,属于?晶体,指出它的一种用途?。
参考答案:(1)Ar
(2)HClO4;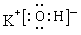
(3)Al;Al2O3+2OH-=2AlO2-+H2O
(4)4NH3+5O2 4NO+6H2O或4NH3+3O2
4NO+6H2O或4NH3+3O2 2N2+6H2O
2N2+6H2O
(5)3NO2+H2O=2HNO3+NO
(6)O=C=O;干冰;分子;人工降雨
本题解析:根据元素在周期表中的分布,可以推知①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K,则
(1)在这些元素中,化学性质最稳定的是稀有气体Ar;
(2)根据元素周期律:同周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,同主族元素的原子,从下到上最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强可以推知酸性最强的含氧酸是高氯酸,碱性最强的是KOH,氢氧化钾是离子化合物,其电子式可表示为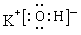 ;
;
(3)氧化铝是两性氢氧化物,所以最高价氧化物是两性氧化物的元素是Al,氧化铝能和强碱反应生成盐和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O;
(4)②氢化物是氨气与③的单质氧气在一定条件下反应的化学方程式为:4NH3+5O2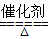 4NO+6H2O或4NH3+3O2
4NO+6H2O或4NH3+3O2 2N2+6H2O。
2N2+6H2O。
(5)红棕色气体是NO2,NO2溶于水生成NO和硝酸,不能用排水法收集,反应的化学方程式为3NO2+H2O=2HNO3+NO
(6)碳与氧生成的化合物是CO2,结构式为O=C=O,CO2在固态时俗称干冰,形成的晶体是分子晶体,可以用作人工降雨。
本题难度:一般