|
高中化学知识点归纳《水的电离平衡》高频试题特训(2019年最新版)(六)
2020-08-13 07:17:20
【 大 中 小】
|
1、选择题 下列说法正确的是
A.将25℃纯水加热至95℃时,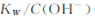 增大 增大
B.将pH=11的Na2CO3溶液加水稀释,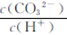 增大 增大
C.室温下,pH=a的盐酸与pH=b的氨水等体积混合后pH=7,则a+b="14"
D.0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合后pH>7,则
| 
参考答案:A
本题解析:?A?水的电离是吸热的过程,温度升高,水离子积常数增大,氢离子浓度和氢氧根离子浓度随着增大,而一定温度下存在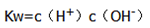 ,由氢离子浓度增大可知 ,由氢离子浓度增大可知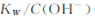 增大,所以A正确?B.溶液稀释过程,氢氧根离子浓度?碳酸根离子浓度减小,依据一定温度下,离子积常数不变可知,氢离子浓度增大,因此B选项错误?C选项室温下,pH=a的盐酸与pH=b的氨水等体积混合,若a+b=14,平衡状态下氢离子浓度和氢氧根离子浓度相同,反应后,一水合氨继续电离生成氢氧根离子,溶液显碱性,pH=7的溶液中氯离子浓度等于铵根离子浓度,因此C选项错误?D0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合,恰好反应生成醋酸钠,依据物料守恒得到 增大,所以A正确?B.溶液稀释过程,氢氧根离子浓度?碳酸根离子浓度减小,依据一定温度下,离子积常数不变可知,氢离子浓度增大,因此B选项错误?C选项室温下,pH=a的盐酸与pH=b的氨水等体积混合,若a+b=14,平衡状态下氢离子浓度和氢氧根离子浓度相同,反应后,一水合氨继续电离生成氢氧根离子,溶液显碱性,pH=7的溶液中氯离子浓度等于铵根离子浓度,因此C选项错误?D0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合,恰好反应生成醋酸钠,依据物料守恒得到 所以D选项错误? 所以D选项错误?
考点:考查了水电离平衡的相关知识点?
本题难度:一般
2、填空题 (8分)
Ⅰ.醋酸是常见的弱酸。用0.1 mol?L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol?L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。
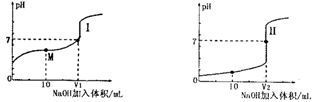
(1)滴定醋酸的曲线是 (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是 。
(3)V1和V2的关系:V1 V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4?2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。

(1)通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式: 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比 。
参考答案:(8分)
I、(1)I (2) 0.1 mol·L-1醋酸溶液 (3)<
(4)c(CH3COO-)>c (Na+)>c (H+)>c (OH-)
Ⅱ、(1)Co3O4 3CoC2O4+2O2 = Co3O4+6CO2 (2)5 : 6
本题解析:Ⅰ、(1)醋酸是弱酸,浓度为0.1 mol?L—1醋酸溶液的PH>1,所以滴定醋酸的曲线是I;
(2)NaOH、HCl、CH3COOH 的浓度相等,均为0.1 mol?L—1,NaOH、HCl属于强碱、强酸,CH3COOH 是弱酸,电离出的c(H+)的浓度较小,对水的电离程度抑制的小,所以滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是醋酸。
(3)当酸碱恰好反应时,盐酸和醋酸消耗NaOH溶液的体积相等,醋酸钠属于强碱弱酸盐,溶液显碱性,当两溶液呈中性时,向醋酸中滴加NaOH的体积要少,所以V1 <V2 .
(4)M点是醋酸钠和醋酸的等浓度混合溶液,溶液显酸,醋酸的电离程度大于CH3COO-的水解程度,则M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c (Na+)>c (H+)>c (OH-)。
Ⅱ、(1)由题意知,二水合草酸钴(CoC2O4?2H2O)的起始质量是18.3g,物质的量为0.1mol,其中Co元素的质量是5.9g,300℃时该固体分解为Co的氧化物,C点固体质量为8.03g,则O元素的质量是8.03g-5.9g=2.13g,物质的量是2.13g/16g?mol-1=0.133125mol,则该固体中Co与O原子的物质的量之比是0.1: 0.133125="3:4," C点剩余固体的化学成分为Co3O4,B点对应的物质的质量是14.70g,与起始的固体质量相比减少18.3-14.7=3.6g,恰好为结晶水的质量,所以B点对应的物质是草酸钴,与氧气在225 ℃~300 ℃发生反应的化学方程式为3CoC2O4+2O2 = Co3O4+6CO2;
(2)设该钴的氧化物中-3价Co的原子个数是x,与盐酸反应得到的黄绿色气体为氯气,物质的量是4.48/22.4=0.2mol,则反应中失去电子的物质的量是0.4mol,Co最终都变为 +2价,则-3价Co得到电子的物质的量是x=0.4,480mL5mol/L盐酸中氯离子的物质的量是0.48L×5mol/L=2.4mol,被氧化的氯离子的物质的量是0.4mol,所以溶液中还余氯离子的物质的量是2.4-0.4=2.0mol,根据氯元素守恒,所以CoCl2的物质的量是1.0mol,则钴的氧化物中+2价钴的物质的量是1.0-0.4=0.6,根据正负化合价的代数和为0,则钴的氧化物中O元素的物质的量是(0.4×3+0.6×2)÷2=1.2mol,所以钴氧化物中Co、O的物质的量之比5:6。
考点:考查酸碱中和滴定,草酸钴的化学性质等知识。
本题难度:困难
3、选择题 25℃时,向纯水中加入NaOH,使溶液的pH=11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为
[? ]
A. 1010:1?
B.? 5×109:1?
C. 108:1?
D. 1:1
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列电离方程式错误的是( ? )
A.H2CO3?2H++CO32-
B.NaHSO4(溶液)=Na++H++SO42-
C.NaHCO3=Na++HCO3-
D.CaCO3=Ca2++CO32-
参考答案:A
本题解析:
本题难度:简单
5、选择题 25℃时,水的电离达到平衡:H2O 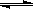 H++OH- ,下列叙述正确的是 H++OH- ,下列叙述正确的是
A. 表示的粒子不会对水的电离平衡产生影响 表示的粒子不会对水的电离平衡产生影响
B.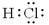 表示的物质加入水中,促进水的电离,c(H+)增大 表示的物质加入水中,促进水的电离,c(H+)增大
C.25℃时, 表示的微粒加入水中,促进水的电离,KW不变 表示的微粒加入水中,促进水的电离,KW不变
D.水的电离程度只与温度有关,温度越高,电离程度越大
|

 为S2—,S2—会结合水电离的H+生成HS—,故S2—会影响水的电离,故A项错误;B.
为S2—,S2—会结合水电离的H+生成HS—,故S2—会影响水的电离,故A项错误;B. 表示的物质加入水中。HCl电离HCl= H++Cl—,故c(H+)增大,抑制水的电离,故B项错误;
表示的物质加入水中。HCl电离HCl= H++Cl—,故c(H+)增大,抑制水的电离,故B项错误; 为CH3COO—,CH3COO—会水解结合水电离的H+,促进水的电离,温度不变则KW不变,故C项正确;水的电离程度不但与温度有关,温度越高,电离程度越大,还与溶液中离子有关,H+、OH-会抑制水的电离,弱酸根或弱碱阳离子均会促进水的电离,故D项错误;本题选C。
为CH3COO—,CH3COO—会水解结合水电离的H+,促进水的电离,温度不变则KW不变,故C项正确;水的电离程度不但与温度有关,温度越高,电离程度越大,还与溶液中离子有关,H+、OH-会抑制水的电离,弱酸根或弱碱阳离子均会促进水的电离,故D项错误;本题选C。