1、简答题 T℃时,向1L固定体积的密闭容器M中加入2mol?X和1mol?Y,发生反应:2X(g)+Y(g)?aZ(g)+W(g)△H=-Q?kJ/mol(Q>0);该反应达到平衡后,放出的热量为QkJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小.请回答下列问题:
(1)化学计量数a的值为______.
(2)下列能说明该反应达到了化学平衡状态的是______(填序号).
a.容器内压强一定
b.容器内气体的密度一定
c.容器内Z的分子数一定
d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2mol?X、1mol?Y和1mol?Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是______kJ.
(4)维持T℃温度不变,若起始时向容器M中加入4mol?X和6mol?Y,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为______kJ.
(5)维持T℃度不变,若在一个和原容器体积相等的恒压容器N中加入2mol?X和1molY,发生题给反应并达到平衡,则______(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M______N(填“>”、“<”或“=”).
(6)该反应的平衡常数随温度变化的情况如表所示:
| 温度/℃ | 200 | 250 | 300 | 350
平衡常数K
9.94
5.2
1
0.5
|
若在某温度下,2mol?X和1mol?Y在容器M中反应并达到平衡,x的平衡转化率为50%,则该温度为______℃.
参考答案:(1)该反应是一个放热反应,升高温度平衡向逆反应方向移动,混合气体的平均相对分子质量减小,则气体反应物计量数之和大于气体生成物计量数之和,所以a=1,故答案为:1;
(2)A、由于反应前后气体的化学计量数之和不相等,则平衡时压强不再发生变化,故A正确;
B、由于是在固定体积的容器中反应,则无论是否达到平衡状态,密度都不变,故B错误;
C、反应达到平衡状态时,物质的浓度、含量、质量等不再发生变化,则平衡时容器内Z分子数一定,故C正确;
D、反应物和生成物都是气体,无论是否达到平衡状态,容器内气体的质量都一定,故D错误.
故答案为:AC;
(3)若起始时向容器M中加入2mol?X、1mol?Y和1mol?Ar(稀有气体不参与反应),X和Y的浓度不变,所以其转化率不变,该反应达到平衡状态时,放出的热量不变为Q,故答案为:Q;
(4)同一容器中,物质的分子数之比等于物质的量之比,当反应达到平衡时容器内的分子数目减少10%时,气体的物质的量减少10%,即气体的物质的量减少(4+6)mol×10%=1mol,根据2X(g)+Y(g)?Z(g)+W(g)知,当气体的物质的量减少1mol时参加反应的X的物质的量是2mol,则反应中放出的热量为QkJ,故答案为:Q;
(5)该条件下,恒压与恒容相比,相当于增大压强,压强越大,反应速率越大,反应到达平衡的时间越短,增大压强平衡向正反应方向移动,则X的质量发生越小,
故答案为:N;>;
(6)2mol?X和1mol?Y在容器M中反应并达到平衡,x的平衡转化率为50%,则平衡时,c(X)=(1-50%)×2mol1L=1mol/L,C(Y)=1mol-1mol×121L=0.5mol/L,c(Z)=c(W)=12×(2×50%)mol1L=0.5mol/L,k=0.5×0.50.5×12=0.5,所以其温度是350℃,故答案为:350℃.
本题解析:
本题难度:一般
2、简答题 合成氨的流程示意图如下:
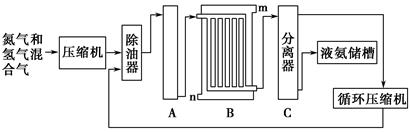
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是____________、____________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学方程式________________________,__________________________。
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为__________________________。
(3)设备B的名称为________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。不宜从相反方向通水的原因是________________________________________。
(4)设备C的作用是____________________________________________。
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g) ?CO2(g)+H2(g)
?CO2(g)+H2(g)
已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
参考答案:(1)液化、分馏 与C反应后除去CO2 C+H2O(g)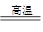 CO+H2 CH4+H2O(g)
CO+H2 CH4+H2O(g) CO+3H2 (2)合成塔 N2+3H2
CO+3H2 (2)合成塔 N2+3H2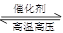 2NH3 (3)冷却塔 n 高温气体由冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好 (4)将液氨和未反应的原料气分离
2NH3 (3)冷却塔 n 高温气体由冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好 (4)将液氨和未反应的原料气分离
(5)13.8
本题解析:(1)利用空气中氮气的沸点比氧气的沸点低,先将空气加压降温变成液态,然后再加热,使氮气首先从液态空气中蒸发出来,留下的就是液态氧气。故分离方法是液化和分馏;另一种方法是将空气与C反应后除去CO2,采用煤和天然气制备H2的化学方程式分别为:C+H2O(g) ?CO+H2、CH4+H2O(g)
?CO+H2、CH4+H2O(g) CO+3H2;(2)合成氨的设备为合成塔;发生的反应是N2+3H2
CO+3H2;(2)合成氨的设备为合成塔;发生的反应是N2+3H2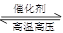 2NH3;(3)冷凝分离氨气的设备为冷却塔;为了增强冷却效果,冷却水应从下端进入,逆向冷却效果好;(4)设备C是分离器,能将液氨和未反应的原料分离;(5)设CO、H2O的起始浓度分别为x mol·L-1、y mol·L-1,且CO的转化率为90%,则
2NH3;(3)冷凝分离氨气的设备为冷却塔;为了增强冷却效果,冷却水应从下端进入,逆向冷却效果好;(4)设备C是分离器,能将液氨和未反应的原料分离;(5)设CO、H2O的起始浓度分别为x mol·L-1、y mol·L-1,且CO的转化率为90%,则
? CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol·L-1) x y 0 0
转化浓度(mol·L-1) 0.9x 0.9x 0.9x 0.9x
平衡浓度(mol·L-1) 0.1x y-0.9x 0.9x 0.9x
K=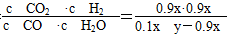 =0.627,得:
=0.627,得: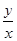 ?≈13.8,只要增加H2O量,就可提高CO的转化率。
?≈13.8,只要增加H2O量,就可提高CO的转化率。
本题难度:困难
3、选择题 在某溶液中进行的反应:A+2B 3C。温度每升高10℃,其反应速率增大到原来的3倍,已知在20℃时v(A)="0.1" mol·L-1·min-1,当其他条件不变时,将温度升高到40℃时,则v(B)应等于(?)
3C。温度每升高10℃,其反应速率增大到原来的3倍,已知在20℃时v(A)="0.1" mol·L-1·min-1,当其他条件不变时,将温度升高到40℃时,则v(B)应等于(?)
A.0.6 mol·L-1·min-1? B.0.9 mol·L-1·min-1
C.1.2 mol·L-1·min-1? D.1.8 mol·L-1·min-1
参考答案:D
本题解析:因为反应中各物质表示的速率之比等于化学方程式中各物质的化学计量数之比,即v(A)∶v(B)=1∶2。已知,在20°C时,v(A)=0.1mol·L-1·min-1,则v(B)="2×v(A)=2×" 0.1mol·L-1·min-1 =0.2mol·L-1·min-1。
根据题意,其反应速率是每升高10°C就增大到原来的3倍,所以当温度从20°C升高到40°C时,v(B)应是0.2mol·L-1·min-1×32=1.8mol·L-1·min-1。
本题难度:简单
4、选择题 可以充分说明反应P(g)+Q(g)

R(g)+S(g)在恒温下已达到平衡的是( )
A.容积不变的反应容器内的密度不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体P、Q、R、S物质的量的浓度之比为1﹕1﹕1﹕1
参考答案:A、无论该反应是否达到平衡状态,容积不变的反应容器内的密度不随时间改变,故A错误;
B、无论该反应是否达到平衡状态,反应容器内P、Q、R、S四者都共存,故B错误.
C、当反应到达平衡,P的生成速率和P的消耗速率相等,而P的消耗速率和S的生成速率相等,所以P的生成速率和S的生成速率相等,故C正确;
D、反应达到平衡时,P、Q、R、S物质的量的浓度之比可能为1﹕1﹕1﹕1,也可能不是1﹕1﹕1﹕1,这与该反应的初始分子数及转化率有关,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 在一定温度下,反应H2(g)+Br2(g)

2HBr(g),达到平衡的标志是( )
A.容器里的压强不随时间的变化而改变
B.单位时间内生成2molHBr的同时,消耗1molH2
C.单位时间内生成2molHBr的同时,生成1molH2
D.正反应和逆反应速率都相等,都等于0
参考答案:A、该反应是反应前后气体分子数不变的可逆反应,压强始终不变,所以不能作为化学平衡状态的判断依据,故A错误.
B、无论该反应是否达到平衡状态,单位时间内生成2molHBr的同时,消耗1molH2,反应方向一致,所以不能作为化学平衡状态的判断依据,故B错误.
C、当单位时间内生成2molHBr的时,消耗1molH2,同时生成1molH2,对于氢气来说,正逆反应速率相等,所以达到平衡状态,故C正确.
D、当达到化学平衡状态时,正逆反应速率相等,但不等于0,故D错误.
故选C.
本题解析:
本题难度:一般