1、选择题 从下列事实所得出的解释或结论正确的是
选项
| 实验事实
| 解释或结论
|
A
| 2N2O5(g) 4NO2(g)+O2(g)?ΔH>0 4NO2(g)+O2(g)?ΔH>0
在室温下能自发进行
| 这是一个熵增的反应
|
B
| 压缩针筒内的NO2和N2O4混合气体,
颜色先变深后变浅
| 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小
|
C
| 锌与稀硫酸反应过程中,开始反应后速率逐渐增大
| 该反应是放热反应
|
D
| 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动
| 反应物的浓度一定降低
|
?
2、选择题 恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)?2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间生成amolA,同时消耗1.5amolB;
③各组分的浓度不再变化;
④混合气体的密度不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦混合气体的平均摩尔质量不再变化;
⑧A、B、C的分子数目比为2:3:2.
A.⑤⑥⑧
B.②⑤⑧
C.①③④
D.②④⑦
3、选择题 下列事实,不能用勒复夏特列原理解释的是?(?)
A.氨水中加酸,NH4+ 的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500℃左右的温度
4、填空题 (17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:
CO(g)+2H2(g) CH3OH(g),现模拟并分析该反应:
CH3OH(g),现模拟并分析该反应:
(1)能够说明该反应已达到平衡的是_________:
a.恒温、恒容时,容器内的压强不再变化
b.恒温、恒容时,容器内混合气体的密度不再变化
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2molH2的同时生成1 mol CH3OH
(2)右图是该反应在不同温度下CO转化率随时间的变化曲线:

①该反应的△H____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数:K1____K2(填“>”、“<”或“=”)。
(3)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。
①甲醇完全燃烧的化学方程式_______________________。
②请写出从C口通入O2发生的电极反应式___________________。
(4)用上述电池做电源,用图2装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极__________________的周围(填“C1”或“C2”)先出现红色。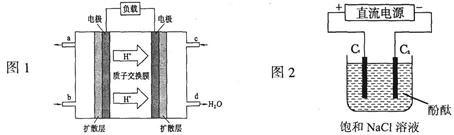
5、选择题 有反应A2+B2 2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是
2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是
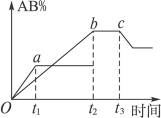
A.AB为气体,A2、B2中必有一种为非气体;正反应吸热
B.AB为气体,A2、B2中必有一种为非气体;正反应放热
C.AB为固体,A2、B2中必有一种为非气体;正反应放热
D.A2、B2、AB均为气体;正反应吸热