1、选择题 如图表示不同温度(T)和压强(p)对可逆反应2L(g) 2M+2N(g)(吸热反应)的影响,且p2>p1。则图中纵轴表示的意义可能是(?)
2M+2N(g)(吸热反应)的影响,且p2>p1。则图中纵轴表示的意义可能是(?)
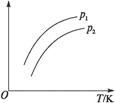
①一定条件下L的转化率②混合气体中M的百分含量③混合气体中L的百分含量④混合气体的平均摩尔质量
A.①②
B.①③
C.②④
D.②
参考答案:A
本题解析:增大压强平衡向左移动,①②符合题意;③④错误,因为都增大。
本题难度:一般
2、选择题 下列说法不正确的是?
A.明矾净水的原理是Al3+水解产生Al(OH)3胶体,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降
B.摩尔盐的制备原理为:6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O,反应之所以能进行的原因是(NH4)2Fe(SO4)?6H2O溶解度最小
C.镀锌铁皮在酸中溶解,当镀层反应完全时,产生氢气的速率会突然减慢
D.将火柴头直接浸入品红溶液中,可以检验火柴头中是否含有硫元素
参考答案:D
本题解析:
答案:D
A.正确,明矾净水的原理是Al3+水解产生Al(OH)3胶体,Al3++3H2O Al(OH)3+3H+ ,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降
Al(OH)3+3H+ ,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降
B.正确,摩尔盐的制备原理为:6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O,反应之所以能进行的原因是(NH4)2Fe(SO4)?6H2O溶解度最小,达到饱和后能从溶液中析出。
C.正确,镀锌铁皮在酸中溶解,当镀层反应完全时,不再形成原电池,反应速率变慢,产生氢气的速率会突然减慢
D.不正确,将火柴头直接浸入品红溶液中,无法检验火柴头中是否含有硫元素,可将它燃烧后,将生成的气体通入品红溶液。
本题难度:一般
3、选择题 可逆反应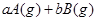


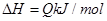 ,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
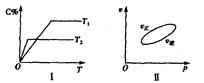
A.T1<T2,Q>0
B.增大压强,物质B的转化率增大
C.反应达平衡后,增加少量的D,平衡逆向移动
D.a+b>c+d
参考答案:B
本题解析:由图像Ⅰ可知,温度为T2时可逆反应先达到平衡状态,当其他条件不变时,温度越高,反应速率越大,达到平衡所用的时间越短,知T2>T1;温度越高,平衡时C的百分含量(C%)越小,说明平衡向左移动,当其他条件不变时,升高温度平衡向吸热方向移动,故反应的正反应为放热反应;由图像Ⅱ可知,当其他条件不变时,随着压强的增大,正速率大于逆反应速率,说明平衡向右移动,当其他条件不变时,增大压强,平衡向气体物质系数减小的方向移动,故正反应为气体物质的量减小的反应,即a+b>c。A、根据上述分析知,T2>T1,Q<0,错误;B、根据上述分析知,增大压强,平衡向右移动,物质B的转化率增大,正确;C、D为固体,反应达平衡后,增加少量的D,平衡不移动,错误;D、根据上述分析知,正反应为气体物质的量减小的反应,即a+b>c,错误。
本题难度:一般
4、选择题 化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:
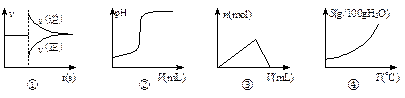
有关上述曲线图的说法正确的是
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.曲线图②可以表示向一定量的盐酸中滴加一定浓度的氢氧化钠溶液时的pH的变化
C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时的产生沉淀的物质的量变化
D.曲线图④可以表示所有的固体物质溶解度随温度的变化
参考答案:B
本题解析:略
本题难度:一般
5、填空题 (共16分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)  xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
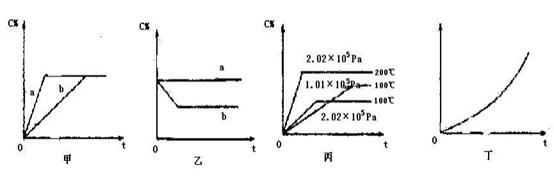
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则?曲线表示无催化剂时的情况,速率:a?b(填:大于、小于或等于)
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则?曲线表示恒温恒容的情况,此时该恒温恒容中
C%?(填:变大、变小或不变)
(3)根据丙图可以判断该可逆反应的正反应是?热反应(填:放热、吸热),计量数x的值是?;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是??,[填:①C% ②A的转化率?③B的转化率④压强⑤c(A)⑥c(B)];升温平衡移动的方向为?。(填:左移或右移)
参考答案:(1)b?大于?(2)a?不变?(3)吸?大于2(或大于等于3)
(4)①②③④?右
本题解析:(1)对于某可逆反应来说,加入催化剂,仅仅是加快反应速率,不影响平衡的移动,所以b曲线表示无催化剂,速率大小为:a大于b;
(2)恒温恒容条件下,加入无关气体氦气,平衡不移动,则曲线a 为恒温恒容,C%不变。
(3)在相同的压强下,温度越高C%的含量越高,即可知该反应的正反应为吸热反应;在相同温度下,压强越大,C%的含量越小,即可知该反应的正反应方向为气体体积增大的反应,x的值大于2(或大于等于3)。
(4)根据图示可知,①②③④符合题意;由于该反应的正反应为吸热反应,升温平衡向右移动。
本题难度:一般