1、选择题 已知相同条件下,HClO的电离常数小于H2CO3的一级电离常数(Ka)。为了提高氯水中HClO的浓度,可加入( )
A.NaCl(s)
B.CaCO3(s)
C.H2O
D.NaOH(s)
参考答案:B
本题解析:根据题给信息CaCO3与HCl反应,但不与HClO反应,加NaCl和NaOH都会造成杂质,而加水会稀释,所以应选B。
本题难度:一般
2、填空题 已知:某种硫酸盐(MSO4)难溶于水,也难溶于硝酸溶液,却可以溶解于某种铵盐溶液中(NH4B),形成无色的溶液。在所形成的无色溶液中通入H2S气体,有黑色沉淀生成(已知HB是一种易溶于水的弱电解质),有关离子方程式可表示为(未知离子可用M2+、B-表示)
___________________________________
参考答案:MSO4+2B-=MB2+SO42-;MB2+H2S=MS↓+2HB
本题解析:
本题难度:一般
3、选择题 下列叙述不正确的是
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.一定温度下,1 L1 mol/L的氨水与2 L0.5 mol/L的氨水中,n(NH4+)前者多
C.相同体积、相同物质的量浓度的盐酸、醋酸,稀释相同倍数后,溶液的pH:盐酸<醋酸
D.0.2 mol/L的一元酸HX与0.1 mol/L的KOH溶液等体积混合所得溶液中,一定有:a(H+)+c(K+)=c(OH-)+c(X-)
参考答案:B
本题解析:
本题难度:一般
4、填空题 (16分)
I.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
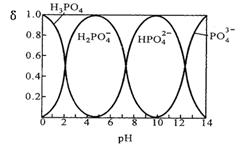
①从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 。
②在Na3PO4溶液中,c(Na+)/c(PO43—) 3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
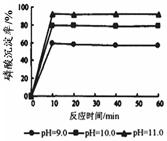
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率 。
II. 在某温度下,把1.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下:

①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)= 。(用含有a、b的式子表示)
参考答案:I.①酸 (1分);H2PO4-在溶液中的电离程度大于水解程度。(1分)
② > (1分), KOH抑制了PO43-的水解(1分);③0.056mmol·/(L·min)(3分)
II. ①4.00×10-4
②如图 (2分)
(2分) ③
③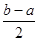 mol/L (2分)
mol/L (2分)
本题解析:I. ①根据图示可知H2PO4-存在的溶液的pH是2—7,所以NaH2PO4溶液呈酸性;这说明H2PO4-在溶液中的电离程度大于水解程度。②在Na3PO4溶液中,由于PO43—水解消耗,所以c(Na+)/c(PO43—)>3;向该溶液中滴入几滴浓KOH溶液,由于c(OH-)增大,水解平衡逆向移动,c(PO43-)增大,所以c(Na+)/c(PO43-)的值减小;③在溶液的pH=10.0时,磷酸的沉淀率是80%,由于开始时磷酸的浓度是0.70mol/L,所以磷酸的沉淀速率是V=(0.70mol/L×80%)÷10min=0.056mmol·/(L·min);II. ①求该温度时,氨水的电离平衡常数K K=c(NH4+)?c(OH-)/c(NH3·H2O)="(0.02mol/L×0.02mol/L" ) ÷1mol/L=4.00×10-4 mol/L;②②在t1时刻时再加入H2O配成2L溶液,由于浓度减小,所以离子的浓度减小,假如电离平衡不发生移动,则c(OH-)=0.01mol/L,而加水稀释,平衡向电离的方向移动,所以c(OH-)有逐渐增大,到t2时刻时重新达到平衡。由于温度不变,所以电离平衡常数不变,K=c(NH4+)?c(OH-)/c(NH3·H2O)= 4.00×10-4 mol/L,假设平衡时c(OH-)=x,则x2/0.5mol/L= 4.00×10-4 mol/L,所以x=1.4×10-2mol/L=0.014mol/L.在t2时刻时重新达到平衡,在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线为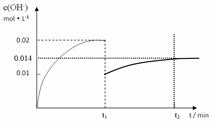 。③若二者等浓度等体积混合,则溶液为NH4Cl溶液,该盐是强酸弱碱盐水解使溶液显碱性,所以若溶液为中性,则应该碱过量,过量的碱电离使溶液的碱性与盐水解是溶液表现的酸性抵消,所以将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)=
。③若二者等浓度等体积混合,则溶液为NH4Cl溶液,该盐是强酸弱碱盐水解使溶液显碱性,所以若溶液为中性,则应该碱过量,过量的碱电离使溶液的碱性与盐水解是溶液表现的酸性抵消,所以将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)=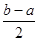 mol/L。
mol/L。
考点:考查溶液的酸碱性与离子的存在的关系、化学反应速率、电离平衡常数的计算、稀释对弱电解质电离平衡的影响的图像法表示及酸碱混合溶液中过量的物质的量浓度的计算的知识。
本题难度:困难
5、填空题 为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:
0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确? (填“正确”或“不正确”),并说明理由 。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系? 。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变 (填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质? (填“能”或“否”),并说明原因 。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质: 。
参考答案:(1)正确 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12
(2)a-2<b<a
(3)浅 能 0.010 mol·L-1氨水(滴有酚酞试液)中加入氯化铵晶体后颜色变浅,有两种可能:一是氯化铵在水溶液中电离出的NH4+水解使溶液显酸性,加入氨水中使其pH降低;二是NH4+使NH3·H2O的电离平衡NH3·H2O NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均可证明NH3·H2O是弱电解质
NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均可证明NH3·H2O是弱电解质
(4)取一张pH试纸,再用玻璃棒蘸取0.1 mol·L-1 NH4Cl溶液,滴在pH试纸上,显色后跟标准比色卡比较测出pH,pH<7(方案合理即可)
本题解析:(1)若NH3·H2O是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12。用pH试纸测出0.010 mol·L-1氨水的pH为10,说明NH3·H2O没有完全电离,应为弱电解质。
(2)若NH3·H2O是强电解质,用蒸馏水稀释至1 000 mL,其pH=a-2。因为NH3·H2O是弱电解质,不能完全电离,a、b应满足a-2<b<a。
(3)向0.010 mol·L-1氨水中加入少量NH4Cl晶体,有两种可能:一是氯化铵在水溶液中电离出的NH4+水解使溶液显酸性,加入氨水中使其pH降低;二是NH4+使NH3·H2O的电离平衡NH3·H2O NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均会使溶液颜色变浅,可证明NH3·H2O是弱电解质。
NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均会使溶液颜色变浅,可证明NH3·H2O是弱电解质。
(4)NH4Cl为强酸弱碱盐,只需检验NH4Cl溶液的酸碱性,即可证明NH3·H2O是弱电解质,还是强电解质。
本题难度:一般