1、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
| X
| Y
| Z
|
初始浓度/mol·L-1
| 0.1
| 0.2
| 0
|
平衡浓度/mol·L-1
| 0.05
| 0.05
| 0.1
|

 下列说法正确的是:
下列说法正确的是:
 A.反应达到平衡时,X的转化率为60%
A.反应达到平衡时,X的转化率为60%
 B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
参考答案:BD
本题解析:反应中X消耗了0.05mol·L-1Y消耗了0.15mol·L-1Z生成了0.1mol·L-1, X的转化率为50%,A错误。反应可表示为X+3Y 2Z,其平衡常数为1600,B正确。增大压强使平衡向正反应方向移动,温度不变,平衡常数不变,C错误。
2Z,其平衡常数为1600,B正确。增大压强使平衡向正反应方向移动,温度不变,平衡常数不变,C错误。
本题难度:简单
2、选择题 某温度下,反应H2(g)+I2(g) ?2HI(g),△H <0,在一带有活塞的密闭容器中达到平衡,
?2HI(g),△H <0,在一带有活塞的密闭容器中达到平衡,
下列说法不正确的是(? )
A.恒温压缩体积,平衡不移动,颜色加深
B.恒压迅速充入HI,开始时正反应速率减小
C.恒容,升温正反应速率减小
D.恒容,充入H2,I2的百分比含量降低
参考答案:C
本题解析:A正确,该反应为等体积反应,压缩体积,平衡不移动,但各组分的浓度均成倍变化;B正确,恒压充入生成物,容器体积增大,反应物的浓度减小,正反应速率开始时速率减小,而开始时逆反应速率突然增大;C错,恒容,升温正反应速率增大;D正确,恒容,充入H2,I2的转化率增大,再次平衡时百分比含量降低。
本题难度:一般
3、填空题 制取硝酸铵的流程图如下:?
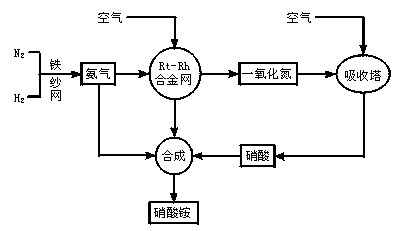
请回答下列问题:?
(1)合成氨的原料通常各来自何处??
(2)已知N2(g)+3H2(g) 2NH3(g),Q>0。请解释:
2NH3(g),Q>0。请解释:
①什么是可逆反应?
②为有效提高氨的产率,实际生产中宜采取哪些措施??
(3)写出氨催化氧化的化学方程式。铂—铑合金网有何作用?为什么铂铑合金网未预热也会发热??
(4)举出硝酸铵的两种主要用途。解释为什么该用途对现代社会非常重要??
(5)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为______________,平衡混合气体中NH3的体积分数为____________________________________。
(6)请你为硝酸厂的选址提出合理化建议。
参考答案:(1)N2取自于空气,H2可来自于水煤气;?
(2)①略;②可采取增压、适当温度和使用铁触媒等措施;?
(3)4NH3+5O2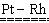 4NO+6H2O,Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,保证Pt-Rt合金网达到一定温度而不必预热;?
4NO+6H2O,Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,保证Pt-Rt合金网达到一定温度而不必预热;?
(4)NH4NO3可作化肥和炸药。前者可促使植物生长,增加农作物产量;后者可用于军事、建设上制造炸药,故该物质对现代社会的发展与和平作用重大;?
(5)30%? 17.6%?
(6)厂址的选择应具备以下有利条件:原料和产品运输方便,生产动力来源充足,废物易于处理,地价较便宜等。
本题解析:(1)氮气主要来自于空气,而氢气可以自于水煤气等。
(2)①在相同条件下,既能向正反应方向进行,又能向逆反应方向进行的反应是可逆反应。②根据反应的方程式可知,该反应是体积减小的、放热的可逆反应。所以为有效提高氨的产率,实际生产中宜采取的措施可以是采取增压、适当温度和使用铁触媒等措施。
(3)氨气催化氧化的方程式是4NH3+5O2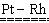 4NO+6H2O,其中Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,能保证Pt-Rt合金网达到一定温度而不必预热。
4NO+6H2O,其中Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,能保证Pt-Rt合金网达到一定温度而不必预热。
(4)NH4NO3可作化肥和炸药。前者可促使植物生长,增加农作物产量;后者可用于军事、建设上制造炸药,故该物质对现代社会的发展与和平作用重大。
(5)氮气和氢气的平均相对分子质量是8.5,所以二者的物质的量之比是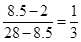 。设反应前氮气和氢气的物质的量分别是1mol和3mol。则
。设反应前氮气和氢气的物质的量分别是1mol和3mol。则
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始量(mol)? 1? 3? 0
转化量(mol)? x? 3x? 2x
平衡量(mol)1-x? 3-3x? 2x
所以有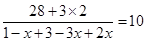
解得x=0.3
因此氮气的转化率是30%
平衡混合气体中NH3的体积分数为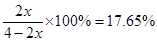
(6)厂址的选择应具备以下有利条件:原料和产品运输方便,生产动力来源充足,废物易于处理,地价较便宜等。
点评:本题是高考中典型的工艺流程题,试题综合性强,对学生的要求高。本题主要是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。解此类型题目的基本步骤是:①从题干中获取有用信息,了解生产的产品。 ②分析流程中的每一步骤,从几个方面了解流程:A.反应物是什么;B.发生了什么反应;C.该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。③从问题中获取信息,帮助解题。
本题难度:困难
4、选择题 一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是?
2Z(g)一定达到化学平衡状态的是?
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①②
B.①④
C.②③
D.③④
参考答案:C
本题解析:X、Y、Z的物质的量之比等于其化学计量数之比,不能作为平衡的标志,①错;X、Y、Z的浓度保持不变可以作为平衡的标志,②对;该反应为反应前后气体分子数不相等的反应,密闭容器中压强保持不变可以作为平衡的标志,③对;单位时间内生成n mol Z的同时生成n mol Y时正逆反应速率相等,④错。
本题难度:一般
5、选择题 在一定温度下,向体积恒定为2L的密闭容器里充入2mol?M和一定量的N,发生如下反应:M(g)+N(g)?E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol?L-1.下列说法正确的是( )
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8mol?L-1?min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol?L-1
参考答案:A、反应开始时,M的浓度为2mol2L=1mol/L,平衡时为0.2mol?L-1,转化了0.8mol?L-1,M转化率为80%.故A正确;
B、4min时,用M表示的反应速率为0.8mol/L4min=0.2mol?L-1?min-1,故B错误;
C、恒温恒容下,充入不反应的稀有气体,各组分的浓度没有发生变化,所以正逆反应速率不变,平衡不移动,M的物质的量不变;故C错误;
D、反应从开始到平衡的过程中,正反应速率越来越小,当进行2min时,M浓度的变化值大于0.4mol?L-1,所以2min时,M的物质的量浓度应小于0.6mol?L-1,故D错误;
故选A.
本题解析:
本题难度:一般