1、选择题 对于可逆反应4NH3(g)+5O2(g)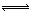 4NO(g)+6H2O(g)下列叙述正确的是(?)。
4NO(g)+6H2O(g)下列叙述正确的是(?)。
A.达到平衡时:4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态。
C.达到平衡时,若增加容器容积,则正反应速率减小,逆反应速率增大
D.化学反应的速率关系是:2v正(NH3)=3v逆(H2O)
参考答案:A
本题解析:A正确;B错,每时每刻均这样反应;C错,达到平衡时,若增加容器容积,反应物与生成物的浓度均减小,则正反应速率减小,逆反应速率减小;D错,化学反应的速率关系是:3v正(NH3)=2v逆(H2O)
本题难度:一般
2、填空题 (14分)氢是一种重要的非金属元素。氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。
已知:
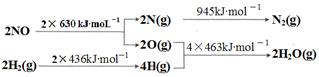
则H2还原NO生成氮气和水蒸气的热化学方程式是:
?。
(2)在一定条件下,用H2将二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2 (g)  CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol·L一1,H2 0.8mol·L一1,CH40.8mol·L一1,H2O1.6mol·L一1。则CO2的平衡转化率为?。上述反应的平衡常数表达式K=?。200℃时该反应的平衡常数K=64.8,则该反应的△H?0(填“>’’或“<”)。
(3)某研究小组以H2与CaCl2制备某种钙的化合物。已知反应只生成甲、乙两种化合物。对产物分析发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为?。
②甲与水反应可得H2,其化学方程式是:
?。
(4)H2的获得途径很多,由哈工大研究小组设计的微生物电解有机废水法,既可以清除废水中的有机杂质,同时可以获得氢气。下图为一种处理含甲醇工业废水的微生物电解池,写出电解过程中,阳极发生的电极反应式:?。

参考答案:(1)2NO(g) +2H2(g)=N2(g) + 2H2O(g)?△H=-665kJ·moL-1(2分)
(2)80%; c(CH4)·c2(H2O)/c(CO2)·c4(H2);<?(各2分)
(3)①HCl(2分)?②2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑(3分)
(4)CH3OH-6e—+H2O=CO2↑+6H+
本题解析:(1)首先写出H2还原NO生成氮气和水蒸气的化学方程式并注明状态:2NO(g) +2H2(g)=N2(g) + 2H2O(g),然后根据键能求出焓变,?H=2×630kJ?mol?1+2×436kJ?mol?1—945kJ?mol?1—4×463kJ?mol?1=-665kJ·moL-1,可得热化学方程式。
(2)设起始时CO2和H2的物质的量浓度分别为x、y;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始浓度(mol?L?1) x? y? 0? 0
变化浓度(mol?L?1) 0.8?3.2? 0.8? 1.6?
平衡浓度(mol?L?1) 0.2? 0.8?0.8?1.6
x=0.8mol?L?1 +0.2mol?L?1 =1mol?L?1,y=3.2mol?L?1 +0.8mol?L?1 =4mol/L;
CO2的平衡转化率=0.8mol?L?1÷1mol?L?1×100%=80%;根据平衡常数的含义可知平衡常数表达式K= c(CH4)·c2(H2O)/c(CO2)·c4(H2);300℃时平衡常数为:0.8×1.62?÷(0.2×0.84)=25,200℃时该反应的平衡常数K=64.8,说明温度升高,平衡常数减小,平衡向逆反应方向移动,则该反应为放热反应,?H<0。
(3)①化合物乙的水溶液显酸性,根据元素守恒知乙为氯化氢。
②化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,还有一种元素,根据反应中元素守恒知,另一种元素为氢元素,则其钙原子、氯原子和氢原子个数之比=52.29%/40:46.41%/35.5:(1-52.29%-46.41%)/1=1:1:1,所以所以甲的化学式为CaHCl,甲和水反应生成氢气,同时生成氯化钙、氢氧化钙,反应方程式为:2CaHCl+2H2O=CaCl2+Ca(OH)2+2H2↑
(4)阳极上发生CH3OH失电子反应,电极方程式为:CH3OH-6e—+H2O=CO2↑+6H+
本题难度:一般
3、填空题 (16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为:
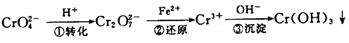
其中第①步存在平衡:

(1)写出第①步反应的平衡常数表达式?。
(2)关于第①步反应,下列说法正确的是?。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要?mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为?。在溶液中存在以下沉淀溶解平衡: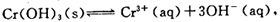 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
?
?
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为?,阴极区反应式为?,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是?。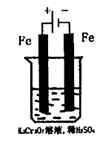
参考答案:

本题解析:
⑴
⑵A C正确,B不正确,为非氧化还原反应;
⑶由电子得失守恒得:1molCr2O72―转移6mol电子,氧化6molFe2+ ,还原0.1 molCr2O2-7离子,需要0.6mol的FeSO4·7H2O。
⑷Fe (OH)3 ,PH=4,C(OH― )=10―10mol/?L,c(Cr3+)=10―32/c2(OH― )=10―2mol/?L>10―5mol/L,因此Cr3+没有沉淀完全。
⑸Fe―2e―=Fe2+ ,2H++2e―=H2↑,在阴极附近溶液pH升高的原因是:2H+ + 2e- = H2↑,阴极附近溶液c(H+)减小,pH升高,产生Cr(OH)3沉淀。溶液中同时产生沉淀还有Fe(OH)3
本题难度:简单
4、选择题 能证明反应:H2(g)+ I2(g)  2HI(g)已经达到平衡状态的是
2HI(g)已经达到平衡状态的是
①c(H2):c(I2):c(HI)=1:1:2
②单位时间内生成nmolH2的同时消耗nmolI2
③反应速率2v(H2)=2v(I2)= v(HI)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
⑥温度和体积一定时,混合气体的颜色不再变化
A.①③
B.②⑥
C.③⑥
D.④⑤
参考答案:B
本题解析:①不能,浓度不再改变才是标志。②可以推出正反应速率等于逆反应速率,是达平衡的标志。③没有说明是正反应速率还是逆反应速率。④本方程反应前后体积不变,所以压强不是标志。⑤本方程反应前后有质量守恒,而体积也不变,所以密度不变,不能作为判断标志。⑥可以作为标志。
点评:本题考查的方程式有一个特殊点,反应前后的计量数之和相等,即反应前后体积不变,这是判断此题的关键。
本题难度:一般
5、选择题 一定温度下,固定体积的密闭容器中发生下列反应:?2HI(g)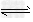 H2(g)+I2(g),若c(HI)由0.1?mol/L降到0.07?mol/L需要15?s,那么c(HI)由0.07?mol/L降到0.05?mol/L,需要的时间为
H2(g)+I2(g),若c(HI)由0.1?mol/L降到0.07?mol/L需要15?s,那么c(HI)由0.07?mol/L降到0.05?mol/L,需要的时间为
[? ]
A.等于5?s?
B.等于10?s
C.大于10?s?
D.小于10?s
参考答案:C
本题解析:
本题难度:简单