1、选择题 在某温度下,H2和I2各0.10mol的气态混合物充入10L的密闭容器中,发生反应:H2(g)+I2(g)  ?2HI(g),充分反应后达到平衡,测得c(H2)=0.008 mol?L-1,则该反应的平衡常数为(?)
?2HI(g),充分反应后达到平衡,测得c(H2)=0.008 mol?L-1,则该反应的平衡常数为(?)
A.40
B.62.5
C.0.25
D.4
参考答案:C
本题解析:平衡时,c(H2)=0.008mol?L-1,则:
H2(g)+I2(g)?2HI(g),
开始(mol/L):0.01? 0.01? 0
变化(mol/L):0.002? 0.002? 0.004
平衡(mol/L):0.008? 0.008? 0.004
故平衡常数k= c2(HI)/ c(I2)?c(H2)=0.0042/0.008×0.008=0.25。
本题难度:一般
2、选择题 在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:

根据以上数据,下列叙述正确的是(? )
A.在上述条件下反应生成1 mol SO3固体放热Q/2 kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
参考答案:D
本题解析:2SO2(g)+O2(g) 2SO3(g)? ΔH="-Q" kJ·mol-1表示2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出Q kJ的热量。由于SO3(g)变成SO3(s)要放出热量,所以在上述条件下反应生成1 mol SO3固体放热大于Q/2 kJ;甲容器中物质不可能完全反应,所以Q1<Q;乙容器中物质不可能完全反应,且相对于甲容器,相当于达平衡后再将甲容器体积扩大为原来的2倍,平衡逆向移动,又吸收部分热量,所以2Q2<Q1;丙容器中物质不可能完全反应且与乙容器中物质的转化率相同,所以Q2=Q3。故有2Q2=2Q3<Q1<Q
2SO3(g)? ΔH="-Q" kJ·mol-1表示2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出Q kJ的热量。由于SO3(g)变成SO3(s)要放出热量,所以在上述条件下反应生成1 mol SO3固体放热大于Q/2 kJ;甲容器中物质不可能完全反应,所以Q1<Q;乙容器中物质不可能完全反应,且相对于甲容器,相当于达平衡后再将甲容器体积扩大为原来的2倍,平衡逆向移动,又吸收部分热量,所以2Q2<Q1;丙容器中物质不可能完全反应且与乙容器中物质的转化率相同,所以Q2=Q3。故有2Q2=2Q3<Q1<Q
本题难度:一般
3、选择题 可逆反应2HI(g)?H2+I2(g)在密闭容器中装入1molHI气体在一定条件下使它分解,已知有35%发生分解,则容器内混合气体的总物质的量是( )
A.0.5mol
B.1mol
C.1.5mol
D.2mol
参考答案:可逆反应2HI(g)?H2+I2(g)反应前后气体的物质的量不变,等于开始加入的HI的物质的量,开始投入1molHI气体
,故容器内混合气体的总物质的量是1mol,故选B.
本题解析:
本题难度:一般
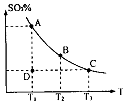
4、计算题 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为: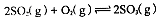 ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
①反应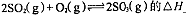 ?0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强?(填“增大”、“减小”或“不变”),平衡?移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量?__(填“增大”、“减小”或“不变”),O2的物质的量浓度?(填“增大”、“减小”或“不变”)。
?0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强?(填“增大”、“减小”或“不变”),平衡?移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量?__(填“增大”、“减小”或“不变”),O2的物质的量浓度?(填“增大”、“减小”或“不变”)。
②若温度为T1、 T2,反应的平衡常数分别为K1、K2?则K1?K2(填“>”、“&l t;”或“=”),反应进行到D点状态时,V正?V逆(填“>”、“<”或“=”)
③在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18 mol,则v(O2)=?mol·L-1·min-1,若继续通入0.20 mol SO2和0.10 mol O2,平衡发生了移动,再次达到平衡后,??mol<n(SO3)<?mol.
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀。请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH—)=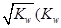 是水的离子积),则这两种溶液可为?(填字母)。
是水的离子积),则这两种溶液可为?(填字母)。
②能体现出NaHCO3在反应中,HCO—3的水解程度小于电离程度的离于方程式为?。
参考答案:(1)①<?增大?逆反应方向?增大?减小
②>? >?③0.036? 0.36? 0.40
(2)①b? c②HCO3-+AlO2-+H2O=Al(OH)3+CO32-
本题解析:(1)①升高温度,平衡向吸热反应方向移动。升高温度,SO3的百分含量减小,逆反应是吸热反应,则正反应是放热反应,
△H<0;再通入SO3,体系压强增大,又要重新达到平衡,平衡应该向逆反应方向移动;恒温恒压下,通入惰性气体,体系容积扩大,相当于压强减小,平衡向逆反应方向移动,SO2的物质的量增大,O2的浓度减小。②此反应正反应是放热反应,低温有利于平衡向正反应方向移动。而平衡常数是生成物浓度幂之积比反应物浓度幂之积,T2>T1,故K1>K2。D点不是平衡点,要达到平衡,SO3的百分含量要增大,故V正>V逆。③
2SO2+? O2 ?2SO3
?2SO3
起始:0.20? 0.10? 0
转化:0.18? 0.09? 0.18
平衡:0.20-0.18? 0.10-0.09? 0.18
v(O2)=0.09/5/0.5=0.036mol·L-1·min-1
可逆反应不能进行到底,故0.36mol<n(SO3)<0.40mol
(2)①“两种溶液恰好完全反应,所得溶液中c(OH—)=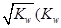 是水的离子积)”,说明反应后溶液呈中性,只能是AlCl3和NaAlO2混合;②NaHCO3与NaAlO2混合溶液呈碱性,说明HCO3-的水解程度小于电离程度。
是水的离子积)”,说明反应后溶液呈中性,只能是AlCl3和NaAlO2混合;②NaHCO3与NaAlO2混合溶液呈碱性,说明HCO3-的水解程度小于电离程度。
本题难度:困难
5、选择题 下列叙述,能肯定判断某化学平衡发生移动的是
A.混合物中各组分的浓度改变
B.混合物的密度改变
C.正、逆反应速率改变
D.反应物的转化率改变
参考答案:D
本题解析:化学平衡发生移动的标志有很多,例如正反反应速率的大小改变,但是改变量不能相等,或者是反应物的转化率改变等等,D选项符合要求;混合物中各组分的浓度改变、混合物的密度改变、正、逆反应速率改变 均不能肯定某化学平衡发生移动。
点评:本题考查了化学平衡的知识,该考点是高考考查的重点和难点,本题有一定的抽象性,有一定的难度。
本题难度:一般