1、实验题 “套管实验”具有装置简洁便利等优点,结合下面的图示回答有关问题。

(1)欲利用图A比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物,最好应在大试管内底部加入 ____(填化学式),石灰水变浑浊的烧杯是 ___(填“甲”或“乙”)。
(2)欲利用图B验证铜与浓硝酸的反应产物,该装置除简洁外,你认为最明显的一个优点是___。
(3)用锌粒和稀硫酸用图C仪器制取并收集一试管氢气,锌粒和稀硫酸应放在____(填“大”或 “小”)试管中组成发生装置,理由是____, 该反应的离子方程式为____。
参考答案:(1) Na2CO3 ;乙
(2)污染物未排入大气,便于控制 反应的进行与停止
(3)小 ;便于收集H2 ;Zn+ 2H+=Zn2++H2↑
本题解析:
本题难度:一般
2、选择题 下列装置或操作能达到实验目的的(?)
参考答案:B
本题解析:略
本题难度:一般
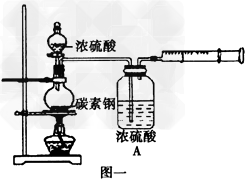
3、实验题 某化学兴趣小组为探究盛装浓硫酸的铁质材料(碳素钢)与热浓硫酸的反应,设计如下实验。
(1)甲同学没计图一实验装置收集反应产生的气体,写出加热条件下碳素钢与浓硫酸反应生成混合气体的化学方程式_____________________。
(2)乙同学设计图二实验装置检验甲同学所收集的气体的成分
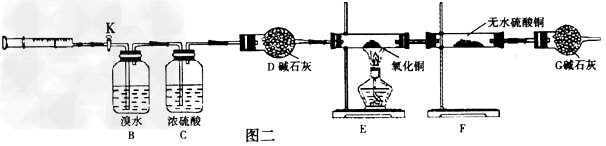
①实验前向B中注入氮气使整个装置充满氮气,实验中将收集到的气体缓缓注入B中,当收集到的气体全部注入B后,还要不断缓缓向B中注入氮气,前后两次向装置中注入氮气,前次的作用是____________,后次的作用是__________________,
②装置B的作用是_________,反应的离子方程式为___________________,
③装置D的作用是__________,装置G的作用是_____________,
④若混合气体中含有氢气,实验过程中能观察到的现象是__________________。
(3)丙同学通过测定混合气体的体积、装置B、D增重的质量来探究混合气体的组成。实验前量取448mL(标准状况下)气体,实验后测得装置B增重0.96g、装置D增重0.088g。
①混合气体中H2的体积分数为_______________;
②若图二实验装置中没有装置C,对实验结果的影响是_______________。
参考答案:(1)2Fe+6H2SO4(浓)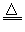 Fe2(SO4)3+3SO2↑+ 6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+ 6H2O、C+2H2SO4(浓)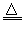 CO2↑+2SO2↑+2H2O、
CO2↑+2SO2↑+2H2O、
Fe+ H2SO4=FeSO4+H2↑
(2)①排出装置中的空气,防止氢气和氧气加热时发生爆炸;使收集到的气体充分反应;
②检验并测定混合气体中的SO2;SO2+Br2+2H2O=4H++SO42-+ 2Br-;③检验并测定混合气体中的CO2;防止空气中的水蒸气进入装置F;④E中固体粉末由黑色变为红色,F中固体由白色变为蓝色
(3)①15%;②CO2的体积分数偏大,H2的体积分数偏小
本题解析:
本题难度:一般
4、选择题 下列实验操作正确的是
①用稀硫酸洗涤长期存放石灰水的试剂瓶;
②用带橡胶塞的棕色试剂瓶存放浓硫酸;
③用盐酸酸化过的FeCl3溶液,除去H2还原CuO实验留在试管内的铜;
④测定某溶液的pH时,先用蒸馏水润湿pH试纸,再甩洁净、干燥的玻璃棒蘸取该溶, 液点在试纸上,并与标准比色卡比较;
⑤分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出;
⑥蒸馏时,将温度计的水银球靠近蒸馏烧瓶支管口。
A.①③
B.②③④
C.②③
D.③⑤⑥
参考答案:D
本题解析:略
本题难度:一般
5、选择题 用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作会使测定结果偏低的是
A.配制NaOH标准液时,所用的NaOH固体中含有少量的KOH杂质
B.滴定前对碱式滴定管仰视读数,滴定后又俯视
C.滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失
D.碱式滴定管用蒸馏水洗净后,直接装入标准NaOH溶液
参考答案:B
本题解析:C(HCL)=C(NaOH)×V(NaOH)/V(HCl)
A?NaOH固体中含有少量的KOH杂质,KOH的摩尔质量大于NaOH,所配溶液c(OH-)偏高,使所测C(HCL)偏高
B?滴定前仰视读数,滴定后又俯视,使V(NaOH)偏小,所测C(HCL)偏低
C?滴定前尖嘴部分有气泡,滴定后气泡消失,使V(NaOH)偏大,所测C(HCL)偏高
D?碱式滴定管只水洗,未润洗,使所测C(HCL)偏高
本题难度:一般