1、简答题 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是______>______>______.
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为______.
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O.
①写出第二步反应的离子方程式______.
②工业生产时需在反应物中加少量Cl-,其作用是______.
③生产中会发生副反应ClO3-+Cl-+H+-Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为
,则起始投料时CH3OH与NaClO3的物质的量之比为______.
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:
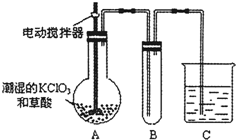
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置______;
②C中应装的试剂为______.C中发生反应的化学方程式为:______.
2、实验题 实验室用稀硝酸与Cu反应来制备NO气体,如果采用图(Ⅰ)装置,由于烧瓶内的空气不易排出,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成。即使可用排水法收集到无色的NO,也无说服力,学生会认为NO是由NO2与H2O反应生成的。有人设计了图(Ⅱ)装置,用来做该实验可以达到满意的效果。
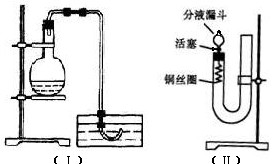
(1)将有关操作补充完全:
①将活塞打开,从U形管的长管口注入稀硝酸,一直注到_______________________为止。
②关闭活塞,用酒精灯在____________加热,当___________时,立即撤去酒精灯。
( 2)回答下列问题:
2)回答下列问题:
①该反应为_________反应。(“吸热”、“放热”)
②反应在什么情况下可以自动停止?可以在何处观察到无色的NO气体?
______________________________________________________________________;
③如果再将活塞慢慢打开,可立即观察到哪些明显现象?
_______________________________________________________________________;
④如果需要再获得NO与已生成的NO2形成鲜明对照的实验效果,应_________(填操作)。
3、实验题 (10分)实验室需要0.10 mol/L NaOH溶液475mL和0.40 mol/L。硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
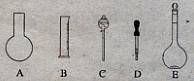
(1)如图所示的仪器中配制溶液肯定不需要的是?(填序号),配制上述溶液还需用到的玻璃仪器是?(填仪器名称)。
(2)人们常将配制过程简述为以下各步骤:
A.冷却
B.称量
C.洗涤
D.定容 E.溶解 F.摇匀。 G.移液