1、选择题 关于元素周期表的说法正确的是( )
A.元素周期表有8个主族
B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期
D.短周期是指第一、二周期
参考答案:A.元素周期表有7个主族,故A错误;
B.ⅠA族的元素除H元素外都是金属元素,故B错误;
C.元素周期表有7个周期,故C正确;
D.短周期是指第一、二、三周期,故D错误;
故选C.
本题解析:
本题难度:简单
2、简答题 如图是元素周期表的一部分,针对表中的①~⑧八种元素,用元素符号或化学式回答相关问题:
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
二
①
三
②
③
④
⑤
⑥
四
⑦
⑧
|
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为______.
(2)地壳中含量最多的金属元素是______.
(3)用电子式表示①与③形成化合物的过程:______.
(4)这些元素的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是______,显两性的是______,该两性物质与②的最高价氧化物对应水化物的溶液反应的离子方程式为______.
(5)①②③④四种元素的简单离子核外电子排布相同,都有______个电子,它们的离子半径由大到小顺序是______(用“>”表示).
(6)①⑤⑧三种元素的单质沸点由高到低的顺序是______(用“>”表示).
参考答案:根据元素周期表中短周期元素的分布情况,可以知道①是F,②是Na,③是Mg,④是Al,⑤是Cl,⑥是Ar,⑦是K,⑧是Br.
(1)在这些元素中,化学性质最不活泼的元素的原子是稀有气体元素的原子,即为Ar,原子结构示意图为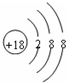 ,故答案为:
,故答案为: ;
;
(2)地壳中含量最多的金属元素是铝,故答案为:Al;
(3)氟化镁是氟离子和镁离子间通过离子键形成的离子化合物,其形成过程为: ,
,
故答案为: ;
;
(4)周期表中从左到右元素最高价氧化物对应水化物的碱的碱性逐渐增减弱,从上到下元素最高价氧化物对应水化物的碱的碱性逐渐增强,所以酸性最强的是HClO4;碱性最强的是KOH;具有两性的是Al(OH)3,既能和强碱反应有能和强酸反应,实质是:Al(OH)3+OH-=AlO2-+2H2O,故答案为:HClO4;KOH;Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(5)F-、Na+、Mg2+、Al3+的简单离子核外电子数均为10,核外电子数一样的离子则核电荷数越多半径越小,即F->Na+>Mg2+>Al3+,故答案为:F->Na+>Mg2+>Al3+;.
(6)氟气、氯气、液溴单质的分子量逐渐增大,沸点由高到低的顺序是Br2>Cl2>F2,故答案为:Br2>Cl2>F2.
本题解析:
本题难度:一般
3、推断题 已知X、Y、Z、W、U五种元素均位于元素周期表的前四周期。X原子的最外层p能级上有3个未成对电子。Y与X处于同周期,Y原子获得2个电子可以形成与氖原子相同的电子层结构的离子。Z是地壳中含量最多的金属元素。W的单质是人类用于生产的第一种金属,它是1939年在河南安阳殷墟出土的鼎的主要成分。U元素的单质在现代电池制造工业上具有不可或缺的地位,该元素对人体的免疫功能有调节作用,能促进儿童的正常发育。请回答下列问题:
(1)X原子的第一电离能比Y原子的第一电离能_______ (填“高”、“低”或“相同”),原因是__________________ ,Y3分子的空间构型为_________________;
(2)通常不用含有W元素的金属或合金来做焰色反应,原因是______________,许多金属盐能用来做焰火 的原因是______________;
(3)Z与U的氢氧化物都属于两性氢氧化物,设计实验鉴别ZCl3溶液与UCl2溶液_____________;
(4)工业上通常采用熔融状态的Z的氧化物而不是氯化物制取Z的原因是__________________;
(5)Y的简单氢化物在固态时的密度比液态时的密度__________(填“大”、“小”或“相同”),原因是____________________。
参考答案:(1)高;氮原子核外电子排布处于半充满状态,原子所具有的能量较低;折线形
(2)Cu元素及其化合物本身具有颜色反应;电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)的光的形式释放能量
(3)分别取少量试样于小试管中,加入过量的氨水,有白色胶状沉淀生成的是AlCl3溶液,先有白色沉淀生成继而沉淀溶解的是ZnCl2溶液
(4)AlCl3属于分子晶体(或极性分子),在熔融状态时不能导电,Al2O3属于离子化合物,在熔融状态下能导电
(5)小;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n,在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀、密度减小
本题解析:
本题难度:一般
4、选择题 下列叙述中,甲金属一定比乙金属活泼性强的是( )
A.甲原子电子层数比乙原子的电子层数多
B.在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极
C.1mol甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙
D.常温时,甲能从水中置换出氢,而乙不能
参考答案:A、如金属不位于同一主族,则不能根据电子层数的多少来判断金属的活泼性强弱,故A错误;
B、在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极,说明乙活泼,故B错误;
C、产生氢气的多少取决于金属失去电子数的多少,与金属的活泼性无关,故C错误;
D、金属的活泼性越强,越易与水反应,故D正确.
故选D.
本题解析:
本题难度:简单
5、填空题 (1)主族元素、副族元素的电子层结构各有什么特点?
(2)周期表中s区、p区、d区和ds区元素的电子层结构各有什么特点?
(3)具有下列电子层结构的元素位于周期表中的哪一个区?它们是金属还是非金属元素?
?ns2、ns2np5、(n-1)d5ns2、(n-1)d10ns2
参考答案:(1)在主族元素中,电子最后填充在最外层的s轨道或p轨道上,最外层电子数在1~8之间,其族序数等于原子最外层上的电子数。在副族元素中,电子最后填充次外层的d轨道,次外层电子数在8~18之间,除第Ⅷ族之外,大多数元素的族序数等于(n-1)d轨道和ns轨道的电子数。
(2)s区:ns1~2; p区:ns2np1~6; d区:(n-1)d1~8ns2; ds区:(n-1)d10ns1-2。
(3)ns2:s区,金属;ns2np5:p区,非金属;(n-1)d5ns2:d区,金属;(n-1)d10ns2:ds区,金属。
本题解析:
本题难度:一般