1、选择题 下列顺序不正确的是
A.热稳定性:HF>HCl>HBr>HI
B.微粒的半径:Cl->Na+>Mg2+>Al3+
C.电离程度(同温度同浓度溶液中):HCl>CH3COOH>NaHCO3
D.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
2、填空题 按所示格式填写下表:

3、选择题 A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应的气态氢化物的稳定性C>D;E是这五种元素的简单离子中半径最小的,则它们的原子序数由小到大的顺序为
A.BB.AC.E
4、选择题 短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是
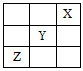
[? ]
A.Z一定是活泼的金属
B.Y的最高价氧化物的水化物是一种强酸
C.Z的最高价氧化物的水化物是强酸
D.1 molY单质跟足量水反应有2mol电子发生转移
5、推断题 U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题: ?
(1)V单质的分子结构式为________;XW的电子式为_________;Z元素在周期表中的位置是
____________。 ?
(2)U、V、W形成的10电子氢化物中,沸点较低的是(写化学式)_________;V、W的氢化物分子结合H+能力较强的是(写化学式)________,用一个离子方程式加以证明_______________________。 ?
(3)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为______________,?由此可知VW和YW2还原性较强的是(写化学式)_______。