1、填空题 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答:
(1)若A为金属单质,B、C为非金属单质,且常温下B、C均为无色气体,E为液体,D为黑色固体,则B的化学式为______,A与E在一定条件下反应生成D的化学方程式为______.
(2)若A为非金属单质,且常温下为黄绿色气体,B为金属单质,C为酸,且C的组成中含有与A相同的元素.则构成非金属单质A的元素原子结构示意图为______,A与E在一定条件下反应生成D的离子方程式为______.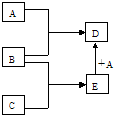
参考答案:(1)B、C为非金属单质,且常温下B、C均为无色气体,E为液体,应为H2O,金属A与水反应生成黑色固体,应为Fe与水的反应,生成的D为Fe3O4,则A为Fe,B为O2,C为H2,A与E在一定条件下反应生成D的化学方程式为3Fe+4H2O(g)?高温?.?Fe3O4+4H2,
故答案为:O2;3Fe+4H2O(g)?高温?.?Fe3O4+4H2;
(2)若A为非金属单质,且常温下为黄绿色气体,应为Cl2,构成非金属单质A的元素原子结构示意图为

,
B为金属单质,由转化关系可知应为变价金属,应为Fe,C为酸,且C的组成中含有与A相同的元素,C应为盐酸,
则E为FeCl2,D为FeCl3,A与E在一定条件下反应生成D的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
故答案为:

;2Fe2++Cl2=2Fe3++2Cl-.
本题解析:
本题难度:简单
2、填空题 (8分)已知A、B、C、D组成的元素都属于短周期,它们之间的简单转化关系如图所示。

请按要求写出有关反应的化学方程式:
(1)若其中A、D为单质且同主族,B、C为氧化物: (该反应在工业上 有重要用途)?。
(2)若A、D为常态下的气体单质且不同主族,B、C为化合物且B为水:?。
(3)若A、B、C均为化合物且C为水,单质D常态下为固体:?。
(4) 若A、D为固体单质且不同主族,B、C为氧化物:?。
参考答案:(共8分)
(1)2C+SiO22CO↑+Si(2分)
(2)2F2+2H2O===4HF+O2(2分)或2Cl2+2H2O4HCl+O2
(3)SO2+2H2S===3S+2H2O(2分)
(4)2Mg+CO22MgO+C(2分)
本题解析:略
本题难度:一般
3、填空题 (12分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
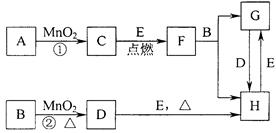
(1)写出有关物质的名称或化学式:F?,H?。
若反应①是在加热条件下进行,则A是?;若反应①是在常温条件下进行,则A是?。
(2)写出B与MnO2共热获得D的离子方程式? ?。
?。
(3 )B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10—4
)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10—4 mo1/L
mo1/L  ,则生成沉淀所需AgNO3溶液的最小浓度为________。若向AgX悬浊液中滴加KI溶液,观察到的现象?,沉淀能够发生转化的原因是?。
,则生成沉淀所需AgNO3溶液的最小浓度为________。若向AgX悬浊液中滴加KI溶液,观察到的现象?,沉淀能够发生转化的原因是?。
参考答案:

本题解析:略
本题难度:一般
4、选择题 下列物质之间的相互转化不符合“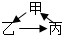 ”(“→”表示一步反应)的是( )
”(“→”表示一步反应)的是( )
A.甲HCl 乙Cl2 丙HClO
B.甲Al(OH)3 乙NaAlO2 丙Al2O3
C.甲CH2=CH2 乙CH3CH2I 丙CH3CH2OH
D.甲NH2CH2COOH 乙NH2CH2CONHCH2COOH 丙H2N[CH2CONHCH2 ]n COOH
参考答案:B
本题解析:
本题难度:一般
5、填空题 有X、Y、Z和W四种元素.已知:①X、Y、Z属同一短周期,其离子以X2+、Y3+、Z-的形式存在.②W和Z组成化合物WZ3溶液遇苯酚呈紫色.请回答:
(1)Z的最高价氧化物对应水化物的名称为______.
(2)X的单质在二氧化碳中燃烧的化学方程式为______.
(3)Y的单质可用于冶炼金属锰,写出Y与二氧化锰反应的化学方程式______,Y的最高价氧化物对应的水化物既可溶于强酸又可溶于强碱,请用电离平衡理论解释其原因______.
(4)当有28.0g?W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为______L.
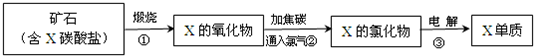
(5)我国陆地上冶炼X的主要流程如图所示,已知当有?lmolX的氧化物参加反应时,有2mol电子转移且生成三种产物,则步骤②反应的化学方程式为______.
(6)在新生代的海水中有一种细菌,它们提取海水中W2+,利用酶为催化剂把W2+转化为氧化物(可用W2O3表示其中W);该反应中的另一种反应物二氧化碳转化为甲醛,请用离子方程式表示上述转化过程(W用具体元素符号表示)______.
参考答案:W和Z组成化合物WZ3溶液遇苯酚呈紫色,则W为Fe,Z为Cl;X、Y、Z属同一短周期,其离子以X2+、Y3+、Z-的形式存在,则X为Mg,Y为Al;
(1)因氯元素的最高化合价为+7价,则对应的最高价氧化物对应水化物为HClO4,其名称为高氯酸,故答案为:高氯酸;
(2)因镁与二氧化碳反应生成氧化镁和碳,反应为2Mg+CO2?点燃?.?2MgO+C,故答案为:2Mg+CO2?点燃?.?2MgO+C;
(3)铝与二氧化锰反应生成氧化铝和锰,其反应为3MnO2+4Al?高温?.?2Al2O3+3Mn,由电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,可知加强酸或强碱时都能使氢氧化铝溶解,
故答案为:3MnO2+4Al?高温?.?2Al2O3+3Mn;在氢氧化铝中存在电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解;
(4)28.0gFe的物质的量为28.0g56g/mol=0.5mol,由3Fe+4H20?高温?.?Fe3O4+4H2,则氢气的物质的量为0.5mol×43,其标况下的体积为23mol×22.4L/mol=14.9L,故答案为:14.9;
(5)由流程图中的反应②可知,氧化镁与碳和氯气反应生成氯化镁和碳的氧化物,lmolMgO参加反应时,有2mol电子转移且生成三种产物,即1mol氯气作氧化剂时,23mol碳作还原剂,
且生成均为13mol的CO2和CO,其反应为3MgO+3Cl2+2C=3MgCl2+CO2+CO,故答案为:3MgO+3Cl2+2C=3MgCl2+CO2+CO;
(6)由Fe2+在酶为催化剂的作用下转化为氧化物(可用Fe2O3表示),该反应中的另一种反应物二氧化碳转化为甲醛,其离子反应为CO2+4Fe2++5H20?酶?.?HCHO+2Fe2O3+8H+,
故答案为:CO2+4Fe2++5H20?酶?.?HCHO+2Fe2O3+8H+.
本题解析:
本题难度:一般