1、填空题 “化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生.如图所示就是一个“化学多米诺实验”,其中A~F装置中分别盛放的物质为:A、稀硫酸;B、锌粒;C、某溶液;D、CaCO3固体;E、滴有紫色石蕊试液的蒸馏水;F、足量的澄清石灰水请回答下列问题:
(1)反应开始后,若E中出现红色,F中有白色沉淀生成,则C中的物质可能是______.
(2)装置D中的离子方程式______,该反应的类型是______,装置F中的离子方程式______.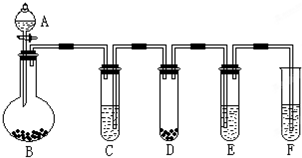
参考答案:“化学多米诺实验”是利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需要控制第一个反应.
(1)应开始后,若E中滴有紫色石蕊试液的蒸馏水出现红色,说明有酸性气体生成;F中足量的澄清石灰水有白色沉淀生成,气体可能为二氧化碳或二氧化硫等,因为D中是碳酸钙固体,F中是澄清石灰水,所以该气体只能是二氧化碳,稀盐酸和稀硝酸都可和碳酸钙反应生成二氧化碳,所以C中的物质可能是稀盐酸或稀硝酸,
故答案为:稀盐酸或稀硝酸;
(2)碳酸钙和酸反应生成钙离子、水和二氧化碳,碳酸钙、水和二氧化碳写化学式,所以装置D中的离子方程式离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑;该反应是酸和盐反应生成另外的酸和盐,所以是复分解反应;二氧化碳使澄清的石灰水变浑浊,二氧化碳和氢氧化钙反应生成碳酸钙和水,所以装置F中反应的离子方程式为CO2+Ca2++2OH-═CaCO3↓+H2O
故答案为:CaCO3+2H+═Ca2++H2O+CO2↑;复分解反应;CO2+Ca2++2OH-═CaCO3↓+H2O.
本题解析:
本题难度:一般
2、实验题 用18 mol/L H2SO4配制100 mL 1.0mol/L H2SO4,若实验仪器有A.100m L 量筒? B.托盘天平? C.玻璃棒? D.50m L容量瓶? E.10m L量筒? F.胶头滴管? G.50m L烧杯? H.100m L 容量瓶
(Ⅰ)实验时选用的仪器有(填序号)________________________配制过程中,下列情况会使配制结果偏高的是(填序号)_______。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
(Ⅱ)在容量瓶使用方法中,下列操作不正确的是(填序号)_______________
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再 用待配液润洗
用待配液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
参考答案:
本题解析:略
本题难度:一般
3、实验题 某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下探究过程。
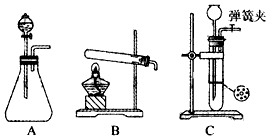
(1)甲同学首先设计了实验室制取二氧化碳的三种发生装置,若选用碳酸氢钠分解制二氧化碳应选用装置是_______(填装置序号“A”“B”或“C”,下同);若用石灰石与稀盐酸为原料,并能控制反应随时发生随时停止,最好应选用的装置是______
(2)乙同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题
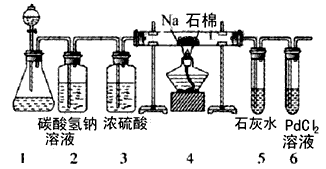
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质),加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为________________________
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为________________________
(3)指导老师认为,不仅要检验残留固体中是否有碳酸钠,还要检验其中是否有C和Na2O。当确认钠充分反应后,请你设计一个简单实验来加以验证。可选用的药品有:蒸馏水、盐酸、NaOH溶液、BaCl2溶液、酚酞、品红。
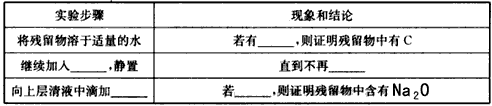
参考答案:(1)B;C
(2)①2Na+2CO2 CO+Na2CO3;②4Na+3CO2
CO+Na2CO3;②4Na+3CO2 7Na2CO3+C (3)
7Na2CO3+C (3)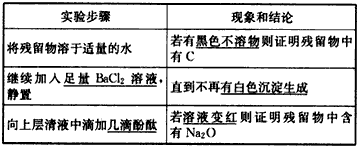
本题解析:
本题难度:困难
4、选择题 只用一种试剂可区别四种溶液Na2SO4、FeCl2、Al2(SO4)3、(NH4)2SO4,此试剂是( )
A.BaCl2溶液
B.稀H2SO4
C.NaOH浓溶液
D.AgNO3溶液
参考答案:A.因Na2SO4、Al2(SO4)3、(NH4)2SO4与BaCl2溶液反应均生成白色沉淀,现象相同,不能区别,故A错误;
B.四种物质与稀硫酸均不反应,现象相同,不能区别,故B错误;
C.Na2SO4、FeCl2、Al2(SO4)3、(NH4)2SO4分别与NaOH溶液反应的现象为:无现象、白色沉淀迅速变为灰绿色最后变为红褐色、白色沉淀后溶解、有刺激性气味的气体,现象不同,能区别,故C正确;
D.四种物质与AgNO3溶液反应均生成白色沉淀,现象相同,不能区别,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验方法不合理的是
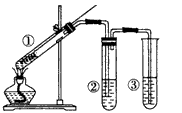
[? ]
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
参考答案:D
本题解析:
本题难度:一般