1、选择题 下列粒子中,不会破坏水的电离平衡的是( )
A.CH3COOH
B.H+
C.OH-
D.Na+
参考答案:D
本题解析:
本题难度:一般
2、填空题 (10分)(1)常温下,向20 mL 0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
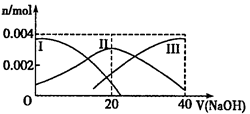
①当V(NaOH)=20mL时,溶液中离子浓度的大小关系: ___________________;
②等体积、等物质的量浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水_________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入___________。
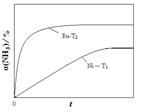
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H=+92.4kJ·mol-1研究来源:91考试网 www.91exAm.org表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
N2(g)+3H2(g) △H=+92.4kJ·mol-1研究来源:91考试网 www.91exAm.org表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是__________(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:如果将反应温度提高到T2,Ru催化分解初始浓度为c0的氨气过程中α(NH3)—t的总趋势曲线(标注Ru—T2)

③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=_____________。
参考答案:(10分)(1)①C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-) (2分)②小;(1分)碱(其他合理答案均可)(2分)(2)① Fe (1分) ②见图曲线 Ru-T2  (2分)
(2分)
③ 0.12c02(2分)
本题解析:(10分)(1)①当氢氧化钠的体积为20毫升时,反应只生成NaHA,根据图像,溶液显酸性,电离大于水解,所以离子浓度关系为C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-);②当二者等浓度等体积混合时,溶质为NaHA,溶液显酸性,电离大于水解,所以抑制水的电离,水的电离程度比纯水的小;要使溶液显中性,需要加入碱或碱性物质。(2)①氨气分解反应的活化能最大的说明反应速率最慢,从图分析,使用Fe做催化剂时反应最慢。②如果将反应温度提高到T2,Ru催化分解,反应速率加快,先达到平衡,氨气的由于温度升高,促进分解,氨气的分解转化增大,所以曲线为:
③氨气分解的平衡转化率为40%,则分解的氨气的浓度为c0*40%,生成氮气的浓度为c0*40%/2,氢气的浓度为c0*40%*3/2,则平衡常数为(c0×40%/2)(c0×40%×3/2)3/c0-c0×40%)2=0.12c02。
考点:酸碱混合后溶液酸碱性的判断,催化剂对反应速率和平衡的影响,化学平衡常数的计算
本题难度:困难
3、填空题 (10分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
| HA物质的量浓度(mol·L-1)
| NaOH物质的量浓度(mol·L-1)
| 混合溶液的pH
|
①
| 0.1
| 0.1
| pH=9
|
②
| c
| 0.2
| pH=7
|
③
| 0.2
| 0.1
| pH<7
|
请回答:
(1) 从①组情况分析, HA是 酸(选填“强”、“弱”)。
(2) ②组情况表明,c 0.2 (填“>”、“=”或“<”)。
(3) 从③组实验结果分析,说明HA的电离程度______NaA的水解程度(填“>”、“=”或“<”),该混合溶液中离子浓度由大到小的顺序是 。
(4) ①组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
参考答案:(共10分)
(1) HA是弱酸;(2) >; (3) > c(A-) >c(Na+) >c(H+)>c(OH-) (4) 10 -5
本题解析:略
本题难度:一般
4、选择题 常温下,将0.06mol/L的H2SO4溶液和0.10mol/L的NaOH等体积混合后,溶液的PH为
A:1.7 B:2.0 C:12.0 D:12.3
参考答案:C
本题解析:略
本题难度:一般
5、选择题 水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
A.水可以电离出离子,所以是强电解质
B.水的离子积可表示KW=c(H+)·c(OH-)
C.常温下水中的c(H+)大于c(OH-)
D.升高温度,c(H+)增大,显弱酸性