1、简答题 实验室中可用如下所示装置验证乙酸、碳酸和石炭酸三者的酸性相对强弱.
请你思考后回答下列问题:
(1)写出下列仪器中所盛装的试剂:
A______,B______,C______.
(2)你认为装置D中装的试剂可能是______溶液,它的作用是:______.
(3)请你选用上述仪器组装成一套装置,可以直接验证上述三种物质的酸性强弱,仪器接口顺序为:a→______.
(4)实验中在烧杯中C中可以观察到的现象应该是______,写出反应的化学方程式:______.
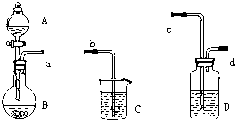
参考答案:(1)验证乙酸、碳酸和石炭酸三者的酸性相对强弱,应该是先利用乙酸与碳酸钙反应生成二氧化碳证明乙酸酸性大于碳酸酸性,然后将生成的二氧化碳通入苯酚钠溶液中,验证碳酸的酸性大于苯酚酸性,所以A装置盛放的是乙酸,B装置盛放的是碳酸钠溶液,C装置盛放的是苯酚钠溶液,
故答案为:乙酸;碳酸钙;苯酚钠溶液;
(2)由于乙酸具有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚,干扰检验碳酸酸性与苯酚酸性的实验,所以将生成的二氧化碳先通过饱和碳酸氢钠溶液除去乙酸,
故答案为:饱和碳酸氢钠溶液;除去二氧化碳中的乙酸;
(3)根据实验目的,先检验醋酸的酸性大于碳酸酸性,然后将二氧化碳中的乙酸杂质除去,再将生成的二氧化碳通入苯酚钠溶液中,检验碳酸的酸性大于苯酚的酸性,实验仪器的连接顺序为:a→c→d→b,
故答案为:c→d→b;
(4)苯酚钠低温下在水中的溶解度减小,二氧化碳和苯酚钠反应生成不易溶于水的苯酚和碳酸氢钠,所以看到的现象是溶液出现浑浊,反应化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为:溶液出现浑浊;C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
本题解析:
本题难度:简单
2、实验题 (12分)某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙两套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a—无水乙醇(沸点:78℃);b—铜丝;c—无水硫酸铜;d—新制氢氧化铜悬浊液。
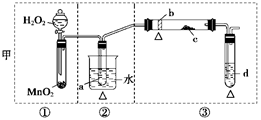
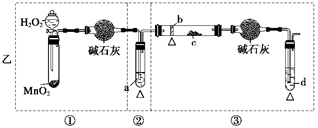
(1)简述两套方案各自的优点:
甲:__________________________________________________________________,
乙:___________________________________________________________________。
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为_________________________________________________________(例如甲①,乙②)。
(3)若要保证此实验有较高的效率,还需补充的仪器有________,理由_______________。
(4)实验中能验证乙醇氧化产物的实验现象是________________________________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式:__________________________________。
参考答案:(1)甲:①中用分液漏斗可以控制液体的流量,控制反应的进行;②中用热水浴加热,可形成较平稳的乙醇气流,使反应更充分;②中的斜、长导管起到冷凝回流乙醇蒸气的作用。(2分)
乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应,避免干扰生成物的验证(2分)
(2)乙①,甲②,乙③(2分)
(3)温度计 控制水浴温度在78℃或略高于78℃,使乙醇蒸气平稳流出,减少挥发,提高反应效率。(2分)
(4)c处无水硫酸铜变蓝;d处生成红色沉淀(2分)
(5)C2H5OHCu△CH3CHO+H2↑(2分)
本题解析:(1)简述两套方案各自的优点:
甲:①中用分液漏斗可以控制液体的流量,控制反应的进行;②中用热水浴加热,可形成较平稳的乙醇气流,使反应更充分;②中的斜、长导管起到冷凝回流乙醇蒸气的作用。
乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应,避免干扰生成物的验证
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为: 乙①,甲②,乙③
(3)若要保证此实验有较高的效率,还需补充的仪器有温度计, 理由是控制水浴温度在78℃或略高于78℃,使乙醇蒸气平稳流出,减少挥发,提高反应效率。
(4)实验中验证乙醇的氧化产物的实验现象是:c处无水硫酸铜变蓝;d处生成红色沉淀
(5) 则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式:
C2H5OHCu△CH3CHO+H2↑
本题难度:简单
3、选择题 甲酸的下列性质中,可以证明它是弱电解质的是( )
A.甲酸溶液使紫色石蕊试液变红
B.甲酸能与水以任何比例互溶
C.10mL?1?mol/L甲酸恰好与10mL?1?mol/L?NaOH的溶液完全反应
D.1mol/L甲酸溶液的pH约为2
参考答案:D
本题解析:
本题难度:简单
4、填空题 (12分)不同的金属在化学反应中表现出来的活泼程度不同,俄国化学家贝开托夫在大量实验和系统研究之后,于1865年发表了金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属 活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________、?。
活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________、?。
工业上又常用下列反应进行金属钾的冶炼: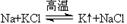 ,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
(2)在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定 量气泡产生,溶液颜色逐渐变浅,一段时间后溶液
量气泡产生,溶液颜色逐渐变浅,一段时间后溶液 逐渐浑浊,试用相关反应方程式进行解释_________________________________、
逐渐浑浊,试用相关反应方程式进行解释_________________________________、
__________________________________________________________________________。
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱?。
②请运用原电 池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。
池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。
方案___________________________ ___________________________________________。
___________________________________________。
参考答案:(1)Hg、Ag?该反应为可逆反应,及时抽出钾蒸气,导致平衡不断正向移动。
(2)Zn+2Fe3+=Zn2++2Fe2+
3Zn+2Fe3++6H2O 2Fe(OH)3↓+3H2↑+3Zn2+
2Fe(OH)3↓+3H2↑+3Zn2+
说明:若写出:Fe3++3H2O Fe(OH)3+3H+,Zn+2H+=Zn2++H2↑给2分。若只写出Fe3++3H2
Fe(OH)3+3H+,Zn+2H+=Zn2++H2↑给2分。若只写出Fe3++3H2 O
O Fe(OH)3+3H+给1分。写化学方程式也可以。
Fe(OH)3+3H+给1分。写化学方程式也可以。
(3)①Fe3+>Cu2+>Fe2+
②方案:将铜棒与碳棒用导线连接,再插入氯化铁溶液,发现有电流产生
本题解析:略
本题难度:简单
5、填空题 某学生设计下列实验来制取、检验HCl气体溶水性及证明酸性:盐酸>碳酸>苯酚
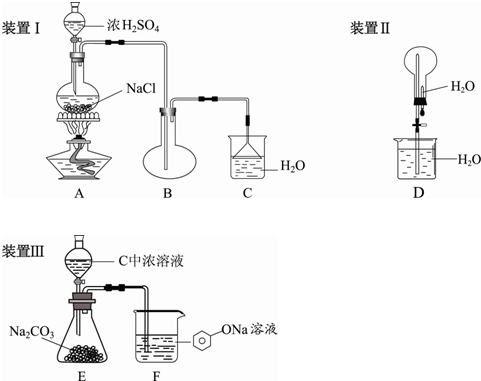
(1)装置III的实验目的是______.
(2)装置I倒置漏斗的作用是______.
(3)如何检验装置II的气密性______.“喷泉”实验的操作方法是______.
(4)装置III要达到实验目的有设计上的不足,请设计出改进方案______.
(5)写出F中反应的离子方程式______,F装置的溶液中电荷守恒的离子浓度关系式______.
参考答案:(1)装置III中能发生的反应是:盐酸和碳酸钠反应生成二氧化碳,二氧化碳、水和苯酚钠反应生成苯酚和碳酸氢钠,根据强酸制取弱酸的原则,能证明酸性:盐酸>碳酸>苯酚,所以实验目的是证明酸性:盐酸>碳酸>苯酚.
故答案为:酸性:盐酸>碳酸>苯酚.
(2)当气体被吸收时,液体上升到漏斗中.由于漏斗的容积较大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中的液体又流回烧杯中,从而防止了倒吸.
故答案为:防止倒吸.
(3)检验装置气密性的方法是:将导管下端插入水中,用手捂住烧瓶,看是否有气泡冒出或在水面下的导管内是否形成一段稳定的空气柱,如果有就证明气密性好,否则不好.
“喷泉”实验的操作方法是:打开止水夹挤出胶头滴管中的水,氯化氢极易溶于水,导致烧瓶中气体压强骤减,外界大气压不变,导致烧杯中的水在大气压是作用下进入烧瓶形成喷泉.
故答案为:将导管下端插入水中,用手捂住烧瓶,看是否有气泡冒出或在水面下的导管内是否形成一段稳定的空气柱,如果有就证明气密性好,否则不好.
打开止水夹挤出胶头滴管中的水.
(4)氯化氢和二氧化碳都和苯酚钠反应生成苯酚,因为氯化氢的存在干扰了二氧化碳和苯酚的反应,所以在二氧化碳和苯酚反应之前要除尽氯化氢气体,改进方案为:从E装置中导出的气体先通入饱和的碳酸氢钠溶液中,再将从饱和碳酸氢钠溶液中出来的气体通入苯酚钠溶液.
故答案为:从E装置中导出的气体先通入饱和的碳酸氢钠溶液中,再将从饱和碳酸氢钠溶液中出来的气体通入苯酚钠溶液.
(5)二氧化碳、水和苯酚钠反应生成苯酚和碳酸氢钠,反应方程式为
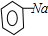
+CO2+H2O→
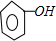
+NaHCO3;溶液中阴离子有HCO3-、CO32-、OH-,阳离子有Na+、H+,根据溶液中阴阳离子所带电荷相等得,C(HCO3-)+2C(CO32- )+C(OH-)+C(C6H5O-)=C(Na+)+C(H+).
故答案为:
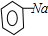
+CO2+H2O→

+NaHCO3;C(HCO3-)+2C(CO32- )+C(OH-)+C(C6H5O-)=C(Na+)+C(H+).
本题解析:
本题难度:一般