|
高考化学知识点总结《原电池原理》试题预测(2020年最新版)(二)
2021-02-18 05:13:15
【 大 中 小】
|
1、选择题 根据图回答,下列说法正确的是( )
A.若a为粗铜,b为纯铜,X为CuSO4,该装置可用于铜的精炼
B.若a为纯铁,b为纯铜,X为CuSO4?该装置用于铁表面镀铜
C.燃料电池中正极反应为: O2(g)+2e-+2H+=H2O
D.当X为NaCl时,b极上产生的气体能使湿润的淀粉KI试纸变蓝
| 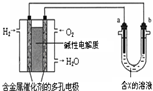
参考答案:左边装置是原电池,投放燃料的电极为负极,投放氧化剂的电极为正极,右边装置是电解池,连接正极的电极是阳极,连接负极的电极是阴极,所以a是阳极b是阴极.
A、电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子与阳极材料含有相同的元素;若a为粗铜,b为纯铜,X为CuSO4,该装置可用于铜的精炼,故A正确.
B、电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子与阳极材料含有相同的元素;若a为纯铁,b为纯铜,X为CuSO4,该装置不能用于铁表面镀铜,应把铜作阳极,铁作阴极,且X为硫酸铜,才能用于铁表面镀铜,故B错误.
C、燃料电池中正极反应为:12O2(g)+2e-+H2O=2OH-,故A错误.
D、当X为氯化钠时,b极上氢离子得电子发生还原反应,所以b极上析出氢气,氢气不能使湿润的淀粉KI试纸变蓝,故D错误.
故选A.
本题解析:
本题难度:简单
2、填空题 过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH)。其化学方程式为
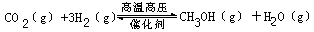
请填空:
(1)写出上述反应的平衡常数表达式:______________________
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如下图所示。下列说法正确的是____________
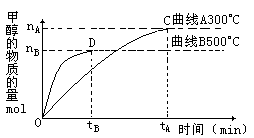
A.在300℃ ,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=nA/tA mol·(L·min)-1
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,n(H2)/n(CH3OH)增大
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,此反应的热化学方程式为: _______________________________
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是____________;正极的电极反应式:__________________。
参考答案:(1)c(CH3OH)·c(H2O)/c(CO2)·c3(H2)
(2)CD
(3)CH3OH(l)+3/2O2(g)==CO2(g)+2H2O(l) △H=-725.8kJ/mol
(4)甲醇、氢氧化钠、水;O2+2H2O+4e-=4OH-
本题解析:
本题难度:一般
3、选择题 在室温下,1L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ | NO3- | Cl-
C(mol/L)
1
1
4
a
|
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电解产物可能存在的溶解现象)下列说法不正确的是( )
A.电解后溶液的PH=0
B.阳极与阴极析出的气体物质的量之比为2:1
C.阴极析出64g铜
D.阳极电解反应:2Cl--2e-=Cl2↑
参考答案:根据溶液呈电中性,溶液中阴阳离子所带电荷相等得氯离子浓度为:1mol/L×1L×2+1mol/L×1L×3=4mol/L×1L×1+nmol/L×1L×1,n=1.
A、n(Cu2+)=1mol/L×1L=1mol,n(Cl-)=1mol/L×1L=1mol,当电路中有3mole-通过时,阴极上除了铜离子全部析出后,还析出氢气;由Cu2+----2e-知,析出铜需要电子的物质的量为2mol,根据2H+---2e----H2知,得1mol电子需要1mol氢离子反应;阳极上除了生成氯气外还有氧气生成,根据2 e-----Cl2,氯离子完全析出需要1mol电子,4OH----4e-知,2mol电子需要2mol氢氧根离子放电,放电的氢离子的物质的量小于氢氧根离子的物质的量,溶液中氢离子浓度为1mol/l,所以pH=0,故A正确.
B、通过3mol电子时,根据2H+---2e----H2知阴极上析出氢气的物质的量为0.5mol,根据2 e-----Cl2,阳极上析出氯气的物质的量为0.5mol,根据4OH----4e----O2知,生成氧气的物质的量为0.5mol,所以阳极与阴极析出的气体物质的量之比为1mol:0.5mol=2:1,故B正确.
C、溶液中铜的物质的量为1mol,由Cu2+----2e-知,当转移3mol电子时,阴极上不仅析出铜还析出氢气,所以铜完全析出,1mol铜的质量是64g,故C正确.
D、当转移3mol电子时,阳极上不仅析出氯气还析出氧气,所以电极反应式有:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,故D错误.
故选D.
本题解析:
本题难度:一般
4、选择题 升高温度,下列数据不一定同时增大的是
A.化学反应速率v
B.弱电解质的电离平衡常数Ka
C.化学平衡常数K
D.水的离子积常数KW
参考答案:C
本题解析:略
本题难度:简单
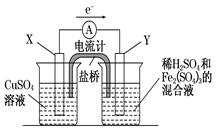
5、填空题 金属铜不溶于稀硫酸,但可溶于铁盐溶液。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式_______________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是_________g,溶液中的c(SO42—)=__________mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则:X极是 (正、负极),电极反应式 。Y极的材料是 ,电极反应式 。
参考答案:(1)Cu+2Fe3+=Cu2++2Fe2+(2分)
(2) 0.64(2分) 0.3(2分)
(3)负极,Cu-2e-=Cu2+ 碳(石墨、金、铂、银), 2Fe3++2e-=2Fe2+(各1分)
本题解析:(1)铜和铁离子反应生成亚铁离子和铜离子,离子反应方程式为:Cu+2Fe3+
本题难度:一般
| 