1、选择题 下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红;?②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
A.①②③④
B.②③④
C.③④
D.②④
参考答案:C
本题解析:①只能说明溶液呈碱性,不能说明一水合氨是强碱还是弱碱,故错误;②只能说明溶液中离子浓度很小,不能说明电解质的强弱,故错误;③说明氯化铵是强酸弱碱盐,故一水合氨是弱碱;④能说明氨水中还有未电离的一水合氨,故是弱碱;故选C。
本题难度:一般
2、填空题 (11分)在t℃时,某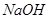 稀溶液中,
稀溶液中, ,
, ,已知
,已知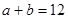 ,则:
,则:
(1)该温度下,水的离子积常数Kw=__________________。
(2)在该温度下,将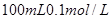 的稀硫酸与
的稀硫酸与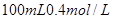 的
的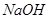 溶液混合后,溶液的pH=_________,此时该溶液中由水电离的
溶液混合后,溶液的pH=_________,此时该溶液中由水电离的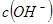 =_________。
=_________。
(3)该温度下,若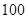 体积
体积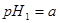 的某强酸溶液与1体积
的某强酸溶液与1体积 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的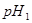 与强碱的
与强碱的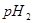 之间应满足的关系是_________。
之间应满足的关系是_________。
(4)该温度下, 的硫酸溶液和
的硫酸溶液和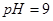 的
的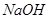 溶液等体积混合后,混合溶液的
溶液等体积混合后,混合溶液的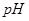 _________(填>7、=7、<7);
_________(填>7、=7、<7); 的醋酸溶液和
的醋酸溶液和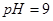 的
的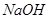 溶液等体积混合后,混合溶液的
溶液等体积混合后,混合溶液的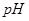 _________(填>7、=7、<7)。
_________(填>7、=7、<7)。
参考答案:(11分,第一个空1分,其它每空2分)(1)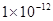
(2)11?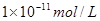
(3) (或
(或 )
)
(4)<7;<7
本题解析:(1)Kw=c(H+)c(OH-)=10-a×10-b=10-(a+b)=10-12(2)首先酸碱中和,NaOH过量,c(OH-)==0.1mol/L,pH=-lg=11,水电离的氢氧根为10-11mol/L,(3)n(H+)=n(OH-),100×10-a=1×10-(12-b),a+b=14;(4)pH=3和pH=9的酸碱,氢离子和氢氧根离子浓度相等,中和后pH=6,醋酸和氢氧化钠中和,醋酸过量呈酸性,pH<6。
本题难度:一般
3、选择题 在已达到电离平衡的0.1 mol·L-1的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是?
? [? ]
A.加少量盐酸
B.加热
C.加少量醋酸钠晶体
D.加氢氧化钠
参考答案:B
本题解析:
本题难度:一般
4、填空题 (1)体积相同时,c(H+)相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率 _____,充分反应后产生氢气的量___(填“相同” “醋酸的多”或“盐酸的多”),原因是____。
(2)在一定量的盐酸中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入___晶体,理由是____; 要使产生氢气的量不变,但反应速率减慢,可加入_________晶体,理由是____。
可供选择的晶体有:
A.纯碱B.烧碱C.胆矾D.醋酸钠E.KHSO4
参考答案:(1)相等 ;醋酸的多 ;当c(H+)相同时,反应开始时的速率相等,c(H+)相同时,醋酸物质的量浓度大,含溶质物质的量多,所以反应放出的氢气多
(2)C ;Zn置换出Cu附在Zn 表面构成原电池,使反应速率加快,但由于溶液中H+的量不变,因此产生氢气的量不变 ;D ;CH3COO -与H+结合成弱电解质CH3COOH,致使溶液中c(H+)降低,使反应速率变慢,而溶液中可提供的H+的数量不变,所以放出的氯气的量不变
本题解析:
本题难度:一般
5、选择题 下列溶液在常温下:①pH=14的NaOH溶液②0.5mol·L-1的NaOH溶液③0.1mol·L-1Na2CO3溶液
④0.1mol·L-1KHCO3溶液?⑤0.1mol·L-1HNO3溶液;由水电离出的c(OH-)由大到小的顺序为:
A.③④⑤①②
B.①②⑤③④
C.⑤④③②①
D.③④⑤②①
参考答案:D
本题解析:水水弱电解质,存在电离平衡H2O H++OH-,因此酸或碱都是抑制水的电离的,氢离子或OH-的浓度越大,对水对抑制程度越大,盐的水解是促进水的电离的,盐的水解程度越大,水的电离程度就越大,所以正确的答案选D。
H++OH-,因此酸或碱都是抑制水的电离的,氢离子或OH-的浓度越大,对水对抑制程度越大,盐的水解是促进水的电离的,盐的水解程度越大,水的电离程度就越大,所以正确的答案选D。
本题难度:简单