1、选择题 一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是(?)
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是(?)
①混合气体的密度不再变化时?②容器内气体的压强不再变化时
③混合气体的总物质的量不再变化时?④ B物质的量浓度不再变化时
⑤当V正(C) = V逆(D) 时?⑥当V正(B) = 2V逆(C)
A.①④⑤⑥? B.②③⑥? C.②④⑤⑥? D.只有④
参考答案:A
本题解析:该反应是个体积不变的反应,②③不是平衡状态的标志。由于总的质量随着A的改变而改变,V不变,密度是平衡状态的标志。①④⑤⑥都是平衡状态的标志。
本题难度:一般
2、填空题 (共11分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法
该法的工艺流程为:
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显?色。
(2)能说明第①步反应达平衡状态的是??。
A.Cr2O2- 7和CrO2- 7的浓度相同? B.2v(Cr2O2- 7)=v(CrO2- 4)? C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)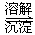 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至?。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为??。
(5)在阴极附近溶液pH升高的原因是(用电极反应式解释) ?。溶液中同时生成的沉淀还有?。
参考答案:(共11分)(1)橙 (1分);(2)C(2分);?(3)5(2分);
(4)阳极反应为Fe-2e-=Fe2+(2分);提供还原剂Fe2+(1分)
(5)2H+ +2e-=H2↑(2分);Fe(OH)3 (1分)
本题解析:(1)pH=2说明溶液显酸性,平衡向正反应方向移动,Cr2O72—的浓度会增大,所以溶液显橙色。
(2)在一定条件下的可逆反应里,当正反应速率和逆反应速率相等,反应物的浓度与生成物的浓度不再改变时,该可逆反应就到达化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此选项A不正确;在任何情况下Cr2O72—和CrO42—的反应速率之比总是满足1:2,因此选项B也不正确;颜色的深浅与浓度有关系,溶液颜色不再改变,这说明Cr2O72—和CrO42—的浓度不再发生改变,因此可以说明反应已经达到化学平衡状态,C正确,答案选C。
(3)由溶度积常数的表达式Ksp=c(Cr3+)·c3(OH—)=10-32可知,当c(Cr3+)=10-5mol/L时,c(OH—)=10-9mol/L,所以pH=5。
(4)Cr2O72—要生成Cr(OH)3沉淀,必需有还原剂,而铁做电极时,在阳极上可以失去电子产生Fe2+,阳极方程式为Fe-2e-=Fe2+。
(5)在电解池中阳离子在阴极得到电子,在溶液中由于H+得电子得能力强于Fe2+的,因此阴极是H+放电,方程式为2H++2e-=H2↑。随着电解的进行,溶液中的H+浓度逐渐降低,水的电离被促进,OH-浓度逐渐升高。由于Fe2+被Cr2O72—氧化生成Fe3+,当溶液碱性达到一定程度时就会产生Fe(OH)3沉淀。
本题难度:一般
3、选择题 在四个不同容器中且不同条件下进行N2+3H2?2NH3反应,根据在相同时间内测定的结果判断生成氨的速率最快的是( ? )
A.V(NH3)=0.5mol?L-1-?min-1
B.V(H2)=0.02mol?L-1-?s-1
C.V(N2)=0.2mol?L-1-?min-1
D.V(H2)=0.3mol?L-1-?min-1
参考答案:B
本题解析:
本题难度:简单
4、选择题 在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g) 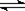 xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是
A.x的值为2
B.A的转化率为40%
C.B的平衡浓度为0.8 mol/L
D.D的体积分数为20%
参考答案:B
本题解析:方程式3A(g)? +? B(g) 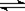 xC(g)? +? 2D(g)
xC(g)? +? 2D(g)
起始物质的量? 1 mol? 1 mol? 0? 0
变化物质的量? 0.6 mol? 0.2 mol? 0.2x mol? 0.4 mol
平衡物质的量? 0.4 mol? 0.8 mol? 0.2x mol? 0.4 mol
所以可得A正确,x=2;B错,A的转化率为60%;C正确B的平衡浓度为0.8 mol/L;D正确D的体积分数为20%;
本题难度:一般
5、选择题 在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入?1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为
A.0.15mol/L
B.0.3mol/L
C.0.225mol/L
D.无法计算
参考答案:C
本题解析:分析:铜与硝酸反应,与硫酸不反应,硫酸存在的情况下,溶液中发生离子反应3Cu+8H++2NO3-=3Cu2++2NO+3H2O,结合铜、硝酸根、氢离子的物质的量根据离子方程式进行过量计算,再根据不足的物质计算铜离子的物质的量,结合c=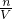 计算铜离子浓度.
计算铜离子浓度.
解答:溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=0.4mol/L×0.1L+0.1mol/L×0.1L×2=0.06mol,
n(NO3-)n=0.4mol/L×0.1L=0.04mol.1.92g铜的物质的量为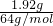 =0.03mol;
=0.03mol;
硝酸和铜反应的离子方程式如下:3Cu+8H++2NO3-=3Cu2++2NO+3H2O?
?3Cu~~~~~8H+~~~~2NO3-~~~~3Cu2+.
?3? ?8?2? 3?
0.03mol?0.08mol?0.02mol?
所以氢离子的物质的量不足,根据氢离子的物质的量计算,由离子方程式可知0.06mol氢离子反应,消耗铜的物质的量为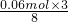 =0.0225mol;所以生成的铜离子的物质的量为0.0225mol.
=0.0225mol;所以生成的铜离子的物质的量为0.0225mol.
所以溶液中c(Cu2+)=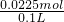 =0.225mol/L.
=0.225mol/L.
故选:C.
点评:本题考查混合物的计算,题目难度中等,根据离子方程式判断离子过量是解答本题关键.
本题难度:简单