1、填空题 Ⅰ.过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
⑴写出H2O2的电子式_________________,其分子内存在______键和_______键。
⑵你认为H2O2被成为“绿色氧化剂”的主要原因是________________________________________。
⑶与H2O2分子具有相同电子数的双原子单质分子为(写化学式)______________,与H2O2分子具有相同电子数的三原子化合物分子为(写化学式)______________。
⑷某工业废水中含有一定量氯气,为了除去氯气,常加入H2O2作脱氯剂,写出该反应的化学方程式为___________________________________________,反应中H2O2作_____________剂。
⑸将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为___________________________________________,反应中H2O2作_____________剂。
⑹双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里:
MnO4-+?H2O2+?H+===?Mn2++?H2O+?。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→ O2
⑴该反应的化学方程式为_____________________________________________。
⑵如反应转移了0.3mol电子,则产生的气体在标准状况下体积为?
参考答案:Ⅰ.⑴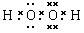 ,极性键?非极性键?⑵H2O2的还原产物为水,对环境无污染
,极性键?非极性键?⑵H2O2的还原产物为水,对环境无污染
⑶F2? H2S?⑷Cl2+H2O2=2HCl+O2↑?还原剂?
⑸2Fe2++H2O2+2H+=2Fe3++2H2O?氧化剂?⑹? 2? 5? 6 = 2? 8? 5O2↑
Ⅱ.⑴3H2O2+2H2CrO4=3O2↑+2Cr(OH)3+2H2O?⑵3.36L
本题解析:Ⅰ.、(1)过氧化氢是含有极性键和非极性键的共价化合物,电子式是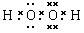 。
。
(2)由于H2O2的还原产物为水,对环境无污染,所以过氧化氢被称为绿色氧化剂。
(3)双氧水中含有18个电子,所以与H2O2分子具有相同电子数的双原子单质分子为F2,而与H2O2分子具有相同电子数的三原子化合物分子为H2S。
(4)氯气具有强氧化性,能把双氧水氧化生成氧气和水,反应的方程式是Cl2+H2O2=2HCl+O2↑。
(5)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,反应的方程式是2Fe2++H2O2+2H+=2Fe3++2H2O。
(6)双氧水中氧元素的化合价从-1价升高到0价,失去1个电子。而高锰酸钾中锰元素的化合价从+7价降低到+2价,得到2个电子,所以根据电子的得失守恒可知,配平后的化学计量数依次是2? 5? 6 = 2? 8? 5O2↑。
Ⅱ.、(1)双氧水生成氧气的过程是被氧化的过程,即双氧水作还原剂,所以铬酸是氧化剂,因此反应的方程式是3H2O2+2H2CrO4=3O2↑+2Cr(OH)3+2H2O。
(2)根据方程式可知,反应中转移6个电子,所以如反应转移了0.3mol电子,则产生的气体是0.15mol,标准状况下的体积是0.15mol×22.4L/mol=3.36L。
本题难度:一般
2、选择题 已知NH4CuSO3与足量的2 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是
A.反应中硫酸做氧化剂
B.NH4CuSO3中硫元素被氧化
C.1 mol NH4CuSO3完全反应转移0.5 mol电子
D.刺激性气味的气体是氨气
参考答案:C
本题解析:NH4CuSO3由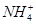 、Cu+、
、Cu+、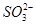 构成,与硫酸反应生成的刺激性气味的气体为SO2,反应后有红色的Cu生成,溶液显蓝色,故有Cu2+生成,则为Cu+发生的歧化反应,此处硫酸体现酸性,1 mol该物质完全反应,转移电子为0.5 mol,A、B错误,C正确;酸性环境中不可能生成NH3,D错误。
构成,与硫酸反应生成的刺激性气味的气体为SO2,反应后有红色的Cu生成,溶液显蓝色,故有Cu2+生成,则为Cu+发生的歧化反应,此处硫酸体现酸性,1 mol该物质完全反应,转移电子为0.5 mol,A、B错误,C正确;酸性环境中不可能生成NH3,D错误。
本题难度:一般
3、选择题 下列叙述正确的是
[? ]
A.含金属元素的离子不一定都是阳离子
B.某元素从化合态变为游离态时一定是被还原
C.在氧化还原反应中,非金属单质不一定是氧化剂
D.金属阳离子被还原一定得到金属单质
参考答案:AC
本题解析:
本题难度:简单
4、选择题 下列说法正确的是(?)
A.置换反应一定属于氧化还原反应
B.分解反应均不属于氧化还原反应
C.复分解反应有的属于氧化还原反应
D.化合反应有的属于氧化还原反应
参考答案:AD
本题解析:置换反应中反应物中和生成物中各一种单质和一种化合物,但形成单质的元素不同,因此这两种元素的化合价一定发生了变化;化合反应中有多种反应物,一种生成物(化合物),则只要反应物中存在单质,就一定是氧化还原反应,都是化合物且元素化合价都没有变,则是非氧化还原反应。
本题难度:简单
5、选择题 氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是
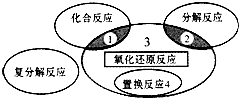
[? ]
A.4Fe(OH)2+O2+2H2O==4Fe(OH)3
B.2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4NH3+5O2 4NO+6H2O
4NO+6H2O
D.Zn+H2SO4==ZnSO4+H2↑
参考答案:C
本题解析:
本题难度:简单