1、填空题 (13分)工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g)  ?2NH3(g)?ΔH=-92.4kJ·mol-1。请回答:
?2NH3(g)?ΔH=-92.4kJ·mol-1。请回答:
(1) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、 H2和NH3的量),反应速率与时间的关系如右图所示。
H2和NH3的量),反应速率与时间的关系如右图所示。
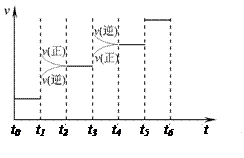
图中t1时引起平衡移动的条件可能是? __?,?t3时引起平衡移动的条件可能是? __? ___?, 其中表示平衡混合物中NH3的含量最高的一段时间是?。
(2) 温度为T ℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的值为? ___________________。请在答题卷上写出具体的计算过程。
参考答案:
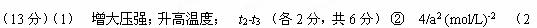
N2(g)? +? 3H2(g)? ?2NH3(g)
?2NH3(g)
起始物质的量浓度(mol.L-1)? 2a? 4a? 0?
物质的浓度变化(mol.L-1)? a? 3a? 2a?
平衡物质的量浓度(mol.L-1)?a? a? 2a?(3分)
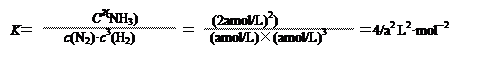 (2分)
(2分)
本题解析:略
本题难度:一般
2、选择题 已知:N2(g)+3H2(g)

2NH3(g);△H=-Q?kJ?mol-1(Q>0).现有甲乙两个相同的密闭容器,向甲容器中充入1mol?N2(g)和3mol?H2(g),在一定条件下达到平衡时放出的热量为Q1?kJ;在相同条件下向乙容器中充入2mol?NH3(g),达到平衡时吸收的热量为Q2?kJ.已知Q2=3Q1,下列叙述中正确的是( )
A.平衡时甲容器中NH3(g)的体积分数比乙容器中的小
B.平衡时甲容器中气体的压强为开始时压强的
C.达到平衡时,甲容器中H2的转化率为25%
D.Q1=Q
参考答案:A、由于1molN2和3molH2完全反应可以生成2molNH3,所以甲乙两个体系的平衡状态是一样的,平衡时甲容器中NH3(g)的体积分数与乙容器中的相等,故A错误;
B、由于1molN2和3molH2完全反应可以生成2molNH3,所以甲乙两个体系的平衡状态是一样的,即三种气体的浓度完全相同. N2和H2完全反应时放热Q,则NH3完全分解时吸热也是Q,假设甲容器中的转化率为x,则放热Q×x=Q1;假设乙容器中的转化率为y,则Q×y=Q2 又Q2=3Q1,所以Q×y=3Q×x,即y=3x,甲乙两个体系的平衡状态是一样的,所以:
? N2(g)+3H2(g)=2NH3(g)
甲起始 1? 3? 0
甲平衡 1-x? 3-3x? 2x
乙起始 0? ?0? 2
乙平衡 y? 3y? 2-2y
对于N2,很明显存在1-x=y,即x+y=1(对其余两种气体也一样)又y=3x,则x=25%,
则平衡时气体的总物质的量为1-0.25+3-0.75+0.5=3.5,根据压强之比等于物质的量之比可知,平衡时甲容器中气体的压强为开始时压强的3.54=78,故B错误;
C、由B解可知达到平衡时,甲容器中H2的转化率为25%,故C正确;
D、根据B解可知,Q×x=Q1,即Q1=0.25Q,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 已知在550℃时,一定容积的容器中发生反应:2SO2+O2 ?2SO3(正反应放热),判断该反应达到平衡状态的标志是
?2SO3(正反应放热),判断该反应达到平衡状态的标志是
A.SO2和SO3浓度相等
B.SO3的生成速率与SO2的消耗速率相等
C.容器中气体的压强不变
D.容器中混合气体的密度保持不变
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度和含量均不再发生变化的状态,把这种状态称为化学平衡状态。A中浓度相等,但正逆反应速率不一定相等,不能说明。B中反应速率的方向是相同的,所以不能说明。反应前后气体的体积是变化的,所以压强也是变化的,因此当压强不再发生变化时,反应即达到平衡状态。密度是混合气的质量和容器容积的比值,在反应过程中,气体质量和容积均是不变的,所以密度始终是不变的,答案选C。
本题难度:一般
4、选择题 在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)?H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25%
B.50%
C.75%
D.80%
参考答案:依据化学平衡,设一氧化碳的消耗浓度为X,分析三段式列式计算:
?CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L)?0.02? 0.02? 0? 0?
变化量(mol/L)? X? X? X? X
平衡量(mol/L)?0.02-X? 0.02-X? X? X
平衡常数K=C(H2)C(CO2)C(CO)C(H2O)=X2(0,02-X)2=9
解得:X=0.015mol/L;
一氧化碳转化率=0.015mol/L0.02mol/L×100%=75%
故选C.
本题解析:
本题难度:简单
5、填空题 一定温度下某容积固定的密闭容器中加入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)  3C(g)+D(s) ΔH=-Q kJ·mol-1(Q>0),当反应达到平衡后,反应放出的热量为Q1 kJ,物质A的转化率为α。请回答下列问题:
3C(g)+D(s) ΔH=-Q kJ·mol-1(Q>0),当反应达到平衡后,反应放出的热量为Q1 kJ,物质A的转化率为α。请回答下列问题:
(1)Q1________Q(填“<”、“>”或“=”),理由是__________________________。
(2)A的转化率α=________(用含Q、Q1的代数式表示);平衡后,若加入少量物质D,A的转化率会________(填“增大”、“减小”或“不变”)。
(3)反应达到平衡后,若升高温度,K________(填“增大”、“减小”或“不变”),混合气体的平均相对分子质量________(填“增大”、“减小”或“不变”)。
(4)维持温度不变,若起始时向容器中加入的物质如下列四个选项,则反应达到平衡后放出的热量仍为Q1 kJ的是(稀有气体不参与反应)________(填字母)。
A.2 mol A、1 mol B、1 mol Ar
B.3 mol C、1 mol D
C.1 mol A、0.5 mol B、1.5 mol C、0.5 mol D
D.2 mol A、1 mol B、1 mol D
参考答案:(1)< 该反应是可逆反应,2 mol A和1 mol B不可能完全反应
(2)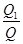 ×100% 不变
×100% 不变
(3)减小 增大
(4)AD
本题解析:本题综合考查了反应热、转化率、化学平衡移动等之间的关系,虽然综合性强,但每一问难度并不是很大,运用解化学平衡类试题的基本技巧即可顺利求解。因是可逆反应,2 mol A和1 mol B不可能完全反应,故Q1<Q,此时A的转化率α=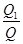 ×100%;平衡后,若加入少量物质D,由于D是固体,浓度不变,故A的转化率不变。因为是放热反应,升高温度,平衡逆向移动,K减小;升高温度时气体质量增大,气体物质的量不变,故混合气体的平均相对分子质量增大;选项A、B、C、D所达平衡状态与原平衡均等效,但只有A、D选项达平衡时放出的热量与原平衡相等。
×100%;平衡后,若加入少量物质D,由于D是固体,浓度不变,故A的转化率不变。因为是放热反应,升高温度,平衡逆向移动,K减小;升高温度时气体质量增大,气体物质的量不变,故混合气体的平均相对分子质量增大;选项A、B、C、D所达平衡状态与原平衡均等效,但只有A、D选项达平衡时放出的热量与原平衡相等。
本题难度:一般