1、填空题 (4分)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
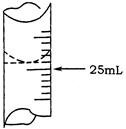
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ??;
(2)乙学生做了三组平行实验,数据记录如下:
实验序号
| 待测NaOH溶液的体积/mL
| 0.1000mol·L-1HCl溶液的体积/mL
|
滴定前刻度
| 滴定后刻度
|
1
| 25.00
| 0.00
| 26.11
|
2
| 25.00
| 1.56
| 31.30
|
3
| 25.00
| 0.22
| 26.31
|
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 ?(小数点后保留四位);
(3)下列哪些操作会使测定结果偏高?(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)? △H= ―24.8 kJ?mol-1
② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)? △H= ―47.2 kJ?mol-1
③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)? △H= +640.5 kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
__________________________________________________。
2、选择题 实验室可用如图所示装置干燥、收集气体R,则R可能是( )
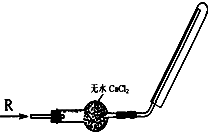
A.NO
B.NO2
C.H2
D.Cl2
3、选择题 可以用如图所示装置干燥、收集及尾气处理的气体是
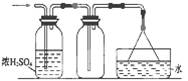
①H2S;②HCl;③NH3;④Cl2;⑤SO2;⑥C2H4
A.①和②
B.②和⑤
C.③和④
D.⑤和⑥
4、选择题 实验室中制取的下列气体中,不能用排空气法收集的是?(?)
A.NO2
B.NH3
C.HCl
D.NO
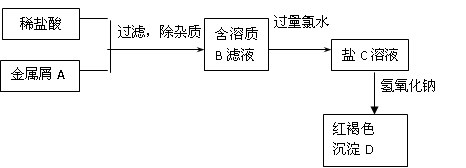
5、填空题 下图表示某种盐C的制备及其性质的实验步骤:
 ?
?
已知:盐C溶液呈黄色;沉淀D焙烧分解,生成红棕色粉末E。
(1)请写出下列物质的化学式:
A?,B?,C?,D?,
(2)写出相应反应的离子方程式
A→B:?,B→C:?,
(3)向B的溶液中滴加NaOH溶液,可观察到白色沉淀产生,该沉淀在空气中放置的现象为?,发生上述变化的化学方程式为?