1、填空题 (4分)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
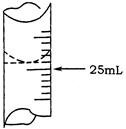
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ??;
(2)乙学生做了三组平行实验,数据记录如下:
实验序号
| 待测NaOH溶液的体积/mL
| 0.1000mol·L-1HCl溶液的体积/mL
|
滴定前刻度
| 滴定后刻度
|
1
| 25.00
| 0.00
| 26.11
|
2
| 25.00
| 1.56
| 31.30
|
3
| 25.00
| 0.22
| 26.31
|
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 ?(小数点后保留四位);
(3)下列哪些操作会使测定结果偏高?(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)? △H= ―24.8 kJ?mol-1
② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)? △H= ―47.2 kJ?mol-1
③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)? △H= +640.5 kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
__________________________________________________。
参考答案:(1)23.80mL
(2)0.1092mol·L-1
(3)AC
(4)CO(g)+FeO(s)=Fe(s)+CO2(g) ?△H=-218.0kJ?mol-1
本题解析:(1)图中滴定管所显示的刻度为23.80mL,则消耗的体积为23.80-1.10=23.80mL。
(2)消耗的盐酸的平均体积为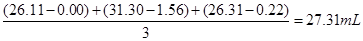
待测液的浓度为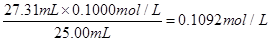
(3)锥形瓶不需要润洗;滴定前酸式滴定管尖端气泡未排除,会导致实际用量变小,从而导致最终结果偏高。
(4)CO(g)+FeO(s)=Fe(s)+CO2(g),其反应热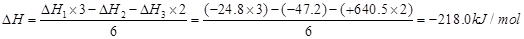
故其热化学方程式为CO(g)+FeO(s)=Fe(s)+CO2(g) ?△H=-218.0kJ?mol-1
点评:在解答本题时,对于中和滴定,应注意酸碱滴定管的使用,碱式滴定管不能装氧化性试剂。另外,对于热化学方程式的书写,其难点在于反应热的计算。计算反应热时,应运用盖斯定律,即将方程式式进行加减乘除,得到目标方程式,相应的反应热也进行加减乘除,即可得到目标方程式的反应热。
本题难度:一般
2、选择题 实验室可用如图所示装置干燥、收集气体R,则R可能是( )
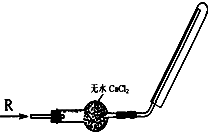
A.NO
B.NO2
C.H2
D.Cl2
参考答案:A.NO的分子量和空气的平均分子量相差不大,故不能用排气法收集,故A错误;
B.NO2分子量为46,比空气的平均分子量29大,应该用向上排气法收集,故B错误;
C.H2的分子量为2,密度小于空气的密度,用向下排气法收集,故C正确;
D.Cl2的分子量为71,密度大于空气密度,应该用向上排气法收集,故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 可以用如图所示装置干燥、收集及尾气处理的气体是
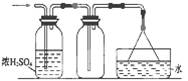
①H2S;②HCl;③NH3;④Cl2;⑤SO2;⑥C2H4
A.①和②
B.②和⑤
C.③和④
D.⑤和⑥
参考答案:B
本题解析:①、H2S具有还原性,能被浓硫酸氧化,所以不能用浓硫酸干燥H2S,错误;②、HCl可用浓硫酸干燥,向上排空气法收集,倒挂的漏斗防止倒吸,正确;③、NH3不能用浓硫酸干燥,错误;④Cl2尾气吸收不需要倒挂的漏斗,错误;⑤SO2可用浓硫酸干燥,向上排空气法收集,倒挂的漏斗防止倒吸,正确;⑥、C2H4密度小于空气,不能用向上排空气收集,错误,故B型正确。
本题难度:一般
4、选择题 实验室中制取的下列气体中,不能用排空气法收集的是?(?)
A.NO2
B.NH3
C.HCl
D.NO
参考答案:D
本题解析:NO具有被氧气氧化生成NO2,所以NO不能用排空气法收集,其余都是可以的,答案选D。
本题难度:一般
5、填空题 下图表示某种盐C的制备及其性质的实验步骤:
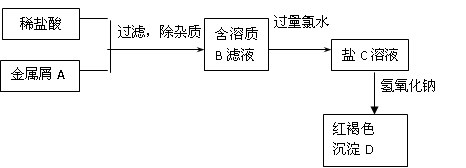 ?
?
已知:盐C溶液呈黄色;沉淀D焙烧分解,生成红棕色粉末E。
(1)请写出下列物质的化学式:
A?,B?,C?,D?,
(2)写出相应反应的离子方程式
A→B:?,B→C:?,
(3)向B的溶液中滴加NaOH溶液,可观察到白色沉淀产生,该沉淀在空气中放置的现象为?,发生上述变化的化学方程式为?
参考答案:(1)? Fe?、? FeCl2 ?、? FeCl3?、? Fe(OH)3?
(2)? Fe + 2H+ = Fe2+ + H2 ↑?、? 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
(3)?白色沉淀转化为灰绿色,最后变成红褐色?
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
本题解析:红褐色沉淀D一定为Fe(OH)3,可判定金属A为铁;
铁与盐酸反应:Fe + 2H+ = Fe2+ + H2 ↑,得到FeCl2,即B溶液;
B溶液中加入大量氯水,被氧化为盐C:FeCl3:2Fe2+ + Cl2 = 2Fe3+ + 2Cl—
盐C与碱溶液反应:Fe3+ +3OH—=Fe(OH)3↓
(3)向B的溶液(FeCl2)中滴加NaOH溶液,可观察到白色沉淀产生:Fe2+ +2OH—=Fe(OH)2↓,该沉淀在空气中易被氧化,白色沉淀转化为灰绿色,最后变成红褐色:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
本题难度:简单