1、实验题 (8分)某化学兴趣小组在甲 、乙两个充满氧气的密闭容器中各加入一定量的碳粉,在高温条件下使其充分反应,待反应结束后,两个容器中的碳粉都已完全消失。该小组成员对反应后两容器内气体进行如下探究:
、乙两个充满氧气的密闭容器中各加入一定量的碳粉,在高温条件下使其充分反应,待反应结束后,两个容器中的碳粉都已完全消失。该小组成员对反应后两容器内气体进行如下探究:
⑴小红同学对甲容器中气体的组成提出如下四种猜想:
①只有CO?②只有CO2?③只有O2?④CO和O2的混合气体
你认为上述猜想中明显不合理的是?(填序号)
⑵小明同学认为甲容器中的气体还可能是CO和CO2的混合气体,为了验证自己的猜想,他准备按下图所示装置进行探究。
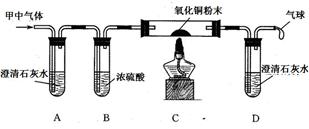
请你回答下列问题:
若小明的猜想成立,则装置A中反应的化学方程式是?;装置C玻璃管中的实验现象是??,反应的化学方程式是?。
⑶小芳同学对乙容器中气体的组成提出了除上述猜想外的另一种合理猜想,她的猜想是?,于是她设计了下列实验方案验证其猜想:
【步骤1】先加热装有铜丝网的玻璃管一段时间后,再通入乙中的气体,观察现象;
【步骤2】将乙中的气体通入澄清石灰水,观察现象。
指导老师在分析其实验方案后,指出了其中存在的错误或不足。
①步骤1应先通入乙中气体一段时间后方可加热。你认为这样修改的原因是?。
②没有必要进 行步骤2的实验,其理由是?。
行步骤2的实验,其理由是?。
⑷若反应前甲、乙两容器中碳粉与氧气的质量比分别表示为(mC/mO2)甲
和(mC/mO2)乙,当小明和小芳的猜想均成立时,则(mC/mO2)甲__________
(mC/mO2)乙(填“﹥”、“﹤”或“=”)。
参考答案:
(1)?③、④;
(2)Ca(OH)2+CO2 ﹦CaCO3↓+H2O;黑色粉末变成红色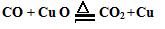
(3)O2和CO2 ;先通一段时间,可以将装置内空气赶出去,避免空气中的氧气对实验造成干扰;如果氧气剩余,则生成物一定是二氧化碳。?
⑷﹥
本题解析:略
本题难度:一般
2、实验题 (15分)亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常1kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:

(1)气体A的主要成分是?,为防止煮沸时发生暴沸,必须先向烧瓶中加入?
?;通入N2的目的是?。
(2)写出甲方案第①步反应的离子方程式:?。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是?
?。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果?(填“偏高”、“偏低”或“无影响”)
(5)若取样品wg,按乙方案测得消耗0.01000mol·L—1I2溶液VmL,则1kg样品中含SO2的质量是?g(用含w、V的代数式表示)。
参考答案:⑴SO2、N2碎瓷片(或沸石)?将生成的SO2全部赶出?
⑵SO2+H2O2=2H++SO2-4?⑶向滴定管注入少量NaOH标准液,倾斜转动滴定管润洗整个滴定管内壁,然后将润洗液从下端尖嘴处放出,重复操作2~3次?⑷无影响?⑸0.64V/w
本题解析:⑴亚硫酸盐与稀硫酸反应生成气体SO2,因此A气体的成分为生成的SO2及通入的N2(其目的是将生成的SO2全部赶出,保证被吸收液全部吸收,减小误差,也可通入稀有气体),为防止液体加热时暴沸,一般可加入碎瓷片。
⑵SO2具有还原性,可被氧化剂H2O2所氧化而吸收,反应的离子方程式为SO2+H2O2===2H++SO2-4。
⑶甲方案的原理是根据消耗的氢氧化钠的量求硫酸的量,进而求SO2的量。乙方案的原理是根据溶液B中的SO32-被I2氧化,由I2的量求SO32-的量,进而求SO2的量。用标准液润洗滴定管的目的是减小误差,否则会使所装溶液浓度减小,造成滴定结果偏大。标准液润洗滴定管的方法是:滴定管用蒸馏水洗涤干净后,加入少量NaOH标准液,将滴定管倾斜放在两手掌上,轻轻转动,润洗整个滴定管内壁,然后将润洗液从下端尖嘴处放出,不可从上口倒出,重复操作2~3次。
⑷乙方案的原理是根据溶液B中的SO32-被I2氧化,由I2的量求SO32-的量,进而求SO2的量。用盐酸代替硫酸,生成的SO2气体中混有少量HCl,因SO2用碱液吸收后需再用盐酸调节溶液至弱酸性,且SO2的量不会因混入HCl而变化,因此消耗的I2不变,即对实验结果无影响。
⑸反应为H2O+SO2-3+I2===SO2-4+2I-+2H+,
SO2~ SO2-3~?I2
64? 1mol
m 0.010 00 mol·L-1?×V×10-3 L=V×10-5 mol
m=64×V×10-5 g,则1 kg样品中含SO2的质量为:64×V×10-5 g×1000/w=0.64V/w
考点定位:本题属工业流程题。以食品中的亚硫酸盐含量的测定为问题情境,通过简明的实验流程图,将实验基本操作、仪器的使用、化学计算、化学方程式的书写等内容综合在一起,考查考生对化学实验方案的分析和问题解决的能力。
本题难度:一般
3、选择题 下列物质的检验,其结论一定正确的是( )
A.某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,沉淀不溶解,则该溶液中一定含有SO42-
B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中至少有SO32-和CO32-中的一种
C.取少量Na2SO3样品于试管中加水溶解后加入盐酸有气体产生,再加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化
D.能使湿润的碘化钾淀粉试纸变蓝的一定是Cl2
参考答案:A.加入BaCl2溶液,产生白色沉淀,可能为AgCl沉淀,不能排除Cl-的干扰,应先加入盐酸酸化,如无现象再加入氯化钡溶液,故A错误;
B.可能含有HCO3-,也能产生二氧化碳气体,故B错误;
C.加水溶解后加入盐酸,可排除SO32-的干扰,如产生沉淀,说明部分被氧化而变质,故C正确;
D.能使湿润的碘化钾淀粉试纸变蓝的气体应为氧化性气体,但不一定为Cl2,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 下列化学实验事实及其解释都正确的是
A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应
B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
D.工业制玻璃的主要反应之一:高温下Na2CO3+SiO2=Na2SiO3+CO2↑