1、选择题 工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费,有人设想利用原电池原理直接制备盐酸,下列说法正确的是
[? ]
A.假设这种想法可行,则可能在制取盐酸的同时,获取电能
B.负极材料用锌,正极材料用石墨,用氢氧化钠作电解质溶液
C.通入氢气的电极为原电池的正极
D.电解质溶液中的阴离子向通氯气的电极移动
参考答案:A
本题解析:
本题难度:简单
2、填空题 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
(1) A ;D (填元素名称)
(2)写出C、D两元素形成的常见化合物的电子式 ;写出由A、B两元素形成的18电子微粒中所含化学键类型 。
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止气体透过的隔膜。在一极通人A的单质,另一极通人B的单质,写出该电池发生的电极反应式:
通入A单质的一极: ;
通入B单质的一极: 。
(4)由A、B、C 三元素构成的化合物X,常在试验制备过程中起尾气吸收作用。请写出化合物X吸收NO2 时所发生反应的离子方程式: 。
参考答案:(1) 氢 ;硫(各1分)
(2) ;(2分);极性共价键、非极性共价键(各一分,只答共价键得一分)
(3)2H2 -4e- + 4OH- = 4H2O O2 +4e- + 2H2O =4OH-(各2分)
(4)2NO2 +2OH- = NO3- +NO2- + H2O(2分)
本题解析:根据元素的结构及有关性质可知,A,B,C,D分别是H、O、Na、S。(1)名称分别是氢、氧、钠、硫。(2))写出C、D两元素形成的常见化合物是硫化钠,其电子式要体现出阴阳离子形式;钠和S都是活泼的金属和非金属,形成的化学键是离子键,电子式为 。A、B两元素形成的18电子微粒是过氧化氢,其中所含化学键类型极性共价键、非极性共价键。符合条件的两种物质分别是硫酸氢钠和亚硫酸氢钠,方程式为HSO3-+H+=SO2↑+H2O。(3)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以氢气在负极通入,氧气在正极通入。又因为溶液显碱性,所以电极反应式为负极:
。A、B两元素形成的18电子微粒是过氧化氢,其中所含化学键类型极性共价键、非极性共价键。符合条件的两种物质分别是硫酸氢钠和亚硫酸氢钠,方程式为HSO3-+H+=SO2↑+H2O。(3)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以氢气在负极通入,氧气在正极通入。又因为溶液显碱性,所以电极反应式为负极: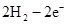

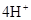 ,正极:
,正极: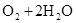
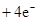

 。(4)由A、B、C 三元素构成的化合物X是氢氧化钠,离子方程式为:2NO2 +2OH- = NO3- +NO2- + H2O。
。(4)由A、B、C 三元素构成的化合物X是氢氧化钠,离子方程式为:2NO2 +2OH- = NO3- +NO2- + H2O。
考点:本题考查元素周期表和周期律对元素的推断,考查了化学键和电极反应式以及二氧化氮的尾气吸收。
本题难度:困难
3、选择题 下列叙述中正确的是
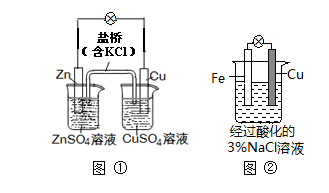
A.图①中正极附近溶液pH降低
B.图①中电子由Zn流向Cu,盐桥中的Cl—移向CuSO4溶液
C.图②正极反应是O2+2H2O+4e? 4OH?
4OH?
D.图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
参考答案:D
本题解析:A、图①中正极为Cu,发生还原反应,Cu2++2e-==Cu,正极溶液由原来的CuSO4溶液变为硫酸钾溶液,pH增大,错误;B、图①中电子由Zn流向Cu,盐桥中的Cl—移向负极ZnSO4溶液,错误;C、图②溶液显酸性,发生的是析氢腐蚀,正极反应是2H++2e-==H2↑,错误;D、图②中铁极失电子成为亚铁离子进入溶液,与K3[Fe(CN)6]溶液产生蓝色沉淀,正确,答案选D。
本题难度:一般
4、填空题 (海水电池)1991年我国首创以铝-空气-海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就会发出耀眼的白光,则电源负极材料为: ,正极材料为: 。正、负极反应分别为: 、 。
参考答案:负极材料为:Al;正极材料为:石墨等能导电的惰性材料或活泼性比铝弱的金属材料。
负极反应:3Al-12e—=3Al3+
正极反应:3O2+6H2O+12e—=12OH-
本题解析:根据原电池构成的条件,活泼金属作负极(失去电子),发生氧化反应;惰性材料作正极(得到电子),发生还原反应。
本题难度:一般
5、选择题 下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.氢氧燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
参考答案:B
本题解析:锂离子电池中能循环使用,属于二次电池,A正确;铜锌原电池中,锌易失电子而作负极,铜作正极,电子从负极沿导线流向正极,B错;燃料电池属于原电池,是将化学能转变为电能的装置,C正确;锌锰干电池中,锌易失电子发生氧化反应而作负极,故D正确。
本题难度:一般