| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《原电池原理》高频试题强化练习(2020年最新版)(六)
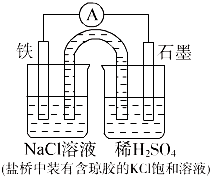 参考答案:D 本题解析: 本题难度:简单 3、填空题 (共10分)如图装置中,已知A、B两池溶液的体积均为200mL: 参考答案:(各2分,共10分) 本题解析:(1)B装置存在自发的氧化还原反应,所以B池是原电池,则A池是电解池; 本题难度:一般 4、选择题 某原电池构造如右图所示。下列有关叙述正确的是(?) 参考答案:C 本题解析:A项取出盐桥后,停止反应,电流计的指针不偏转;B项在外电路中,电子由铜电极流向银电极;C项正确;D项盐桥中没有电子的移动,是离子的移动。 本题难度:一般 5、选择题 有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为 参考答案:D 本题解析:当A、B组成原电池时,电子流动方向A→B,则金属活泼性为A>B;当A、D组成原电池时,A为正极,则金属活泼性为D>A;B与E构成原电池时,电极反应式为:E2-+2e-→E,B-2e-→B2+,B失去电子,则金属活泼性为B>E,综上所述,金属活泼性为D>A>B>E,故选D. 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《影响盐类水.. | |