1、填空题 (每空1分,共7分)下表为元素周期表的一部分,请回答有关问题:
?
| IA
| IIA
| IIIA
| IVA
| VA
| VIA
| VIIA
| 0
|
2
| ?
| ?
| ?
| ?
| ①
| ?
| ②
| ?
|
3
| ?
| ③
| ④
| ⑤
| ?
| ⑥
| ⑦
| ⑧
|
4
| ⑨
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
|
(1)⑤和⑧的元素符号是_________和__________;
(2)表中最活泼的金属是_________,非金属性最强的元素是_________;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是______,分别写出该元素的氢氧化物与⑥、⑨
的最高价氧化物对应水化物反应的化学方程式__________________________________;
__________________________________.
参考答案:(1)、Si? Ar?(2)K? F?
(3)Al? 2Al(OH)3+3H2SO4=2Al2(SO4)3+3H2O? Al(OH)3+KOH=KAlO2+2H2O
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断①~⑩分别为N、F、Mg、Al、Si、S、Cl、Ar、K、Br。同周期元素自左向右金属性逐渐减弱,非金属性逐渐增强。同主族自上而下金属性逐渐增强,非金属性逐渐减弱。所以金属性最强的是K,非金属性最强的是F。氢氧化铝是两性氢氧化物既能溶于强碱,也能溶于酸中。
本题难度:一般
2、选择题 下图是周期表中短周期的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是
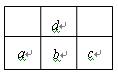
A.a与c不能形成化合物
B.氢化物比的稳定性:d>b
C.原子半经的大小顺序是:c>b>a>d
D.a、b、c的最高价氧化物对应水化物的酸性强弱的关系是:c>b>a
参考答案:AC
本题解析:略
本题难度:简单
3、选择题 下列基态原子的电子构型中,正确的是
A.3d94s2
B.3d44s2
C.3d104s0
D.3d84s2
参考答案:D
本题解析:略
本题难度:简单
4、填空题 A 、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,非金属性较强的元素在周期表中的位置为?,以下三种说法中,可以验证C和E非金属性强弱的是?。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素显负价
c.比较这两种元素的气态氢化物的稳定性
(2)用元素符号表示B,C,D三种元素的第一电离能由大到小的顺序为?。
(3)盐M中含有的化学键类型有?,B的最高价含氧酸N,常温下,若M,N两种溶液的pH均等于5,则由水电离出的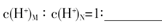
(4)D元素的最高价氧化物对应水化物能与地壳中含量最多的金属元素形成的单质反应,试写出该反应的离子方程式?,用离子方程式表示该反应生成的盐溶液显碱性的原因?
(5)C和D按原子个数比1:1形成一种离子化合物R,已知常温时R与水反应,恢复至原状态测得:每转移1 mol电子放出QkJ的热量,试写出R与水反应的热化学反应方程式?。
参考答案:(1)第二周期ⅥA族,bc;(2)N>O>Na;(3)离子键、共价键;10—4;
(4)2Al + 2OH- + 2H2O=2AlO2- + 3H2↑,AlO2- + 2H2O  ?Al(OH)3 + OH-;
?Al(OH)3 + OH-;
(5)2Na2O2(s)+2H2O(g)=4NaOH(aq)+O2(g)△H=—2QkJ/mol。
本题解析:根据题意知,A 、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐M,则B为N,M为硝酸铵;E元素原子的最外层电子数比次外层电子数少2,则E为S;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物,则C为O。(1)C为O,E为S,氧与硫同主族,从上到下非金属性在减弱,则非金属性较强的元素为O,在周期表中的位置为第二周期ⅥA族,以下三种说法中,可以验证C和E非金属性强弱的是a.元素的非金属性强弱与单质的沸点高低无关,错误;b.二者形成的化合物中,氧元素显负价,说明氧元素的得电子能力比硫强,氧元素的非金属性比硫强,正确;c.元素的气态氢化物的稳定性越强,元素的非金属性越强,正确,选bc;(2)B为N,C为O,D为Na,根据同周期元素由左向右元素的第一电离能呈递增趋势,但氮原子最外层p轨道为半充满状态,较稳定,第一电离能:N>O;Na为活泼金属,第一电离能最小,三种元素的第一电离能由大到小的顺序为N>O>Na;(3)盐M为硝酸铵,含有的化学键类型有离子键、共价键;硝酸溶液中分析水的电离,计算其中氢氧根的浓度,硝酸铵溶液中的氢离子全部来自水的电离,常温下,两种溶液的pH均等于5,则由水电离出的氢离子浓度分别为10—9mol/L、10—5mol/L,c(H+)HNO3:c(H+)NH4NO3=1:10—4;(4)氢氧化钠溶液与单质铝反应生产偏铝酸钠和氢气,离子方程式为2Al + 2OH- + 2H2O=2AlO2- + 3H2↑,用离子方程式表示该反应生成的盐溶液显碱性的原因AlO2- + 2H2O  ?Al(OH)3 + OH-; (5)O和Na按原子个数比1:1形成一种离子化合物过氧化钠,根据题给信息写出过氧化钠与水反应的热化学反应方程式为
?Al(OH)3 + OH-; (5)O和Na按原子个数比1:1形成一种离子化合物过氧化钠,根据题给信息写出过氧化钠与水反应的热化学反应方程式为
2Na2O2(s)+2H2O(g)=4NaOH(aq)+O2(g)△H=—2QkJ/mol。
本题难度:一般
5、选择题 同位素2H、15N、18O、34S等常被用做陆地生态分析研究。下列说法中正确的是
A.16O和18O是同一种核素
B. 1H218O的摩尔质量为20
C.34S和15N核内的中子数相差9
D.2H+核外电子数为0
参考答案:D
本题解析:选项A不正确,16O和18O中质子数相同,但质量数不同,互为同位素;摩尔质量的单位是g/mol,选项B不正确;34S和15N核内的中子数分别是34-16=18、15-7=8,因此中子数相差10,选项C不正确,所以正确的答案选D。
本题难度:一般