1、选择题 实验室里由粗盐制备精盐的实验中,必需的操作步骤有
A.溶解
B.过滤
C.分液
D.蒸发浓缩
参考答案:ABD
本题解析:粗盐精致需要通过溶解、过滤、蒸发,所以答案是ABD。
本题难度:困难
2、填空题 已知M2+离子3d轨道上有5个电子,则
(1)M原子的外围电子排布图(轨道表示式)为:?。
(2)M原子的最外层电子数为?个;最高能级中电子数为?个。
(3)M元素在周期表中的位置是:?。
参考答案:(1)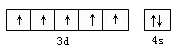 ?(2)2;5?(3)第四周期;ⅦB族
?(2)2;5?(3)第四周期;ⅦB族
本题解析:已知M2+离子3d轨道上有5个电子,则M的原子序数是2+8+13+2=25,即M是Mn元素。
(1)根据构造原理可以得出锰原子的外围电子排布图。
(2)Mn原子的最外层电子数是2个,最高能级是3d,含有5个电子。
(3)锰元素位于元素周期表的第四正确第ⅦB族。
点评:该题是基础性试题的考查,难度不大。该题的关键是熟练掌握构造原理,然后依据核外电子排布得出该元素在周期表中的位置即可,有利于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般
3、选择题
元素X、Y、Z的原子序数都小于18,X的阳离子,Y的阳离子和Z的阴离子都具有相同的电子层结构,Y的阳离子半径小于X的阳离子半径,则元素X、Y、Z的原子序数由小到大的顺序依次是(?)
A.Z、Y、X
B.Y、Z、X
C.Y、X、Z
D.Z、X、Y
参考答案:D






本题解析:
这种题可选用特殊值代入法。据题意,可认为X-Na,Y-Mg,Z-F,即知答案为D。其中,具有相同的电子层结构的离子,核电核数越大,半径反而越小。
本题难度:一般
4、选择题 短周期元素X、Y、Z、W在周期表的位置如图所示,其中X元素所处的周期序数与族序数相等。下列判断正确的是
?
A.气态氢化物的稳定性:Y>Z
B.一定条件下,Z单质与W的常见单质直接反应生成ZW2
C.原子半径:X>Y>Z>W
D.Y、Z的最高价氧化物均为共价化合物
参考答案:CD
本题解析:观察图中元素的位置可知,X是位于第三周期第IIIA族的铝元素,以此为突破口推导,Y、Z、W是硅、氮、氧。Y、Z分别是硅、氮,由于非金属性:Si<P<N,非金属性越强气态氢化物越稳定,则硅的气态氢化物(或SiH4)的稳定性小于氮的气态氢化物(或NH3),故A选项错误;Z、W分别是氮、氧,N2与O2在放电或高温下反应,只能直接生成NO,不能直接变成NO2,故B选项错误;由于原子半径:Al>Si>P>N>O,故C选项正确;Y、Z分别是硅、氮,它们都是非金属元素,二者形成的最高价氧化物都是共价化合物,分别为二氧化硅、五氧化二氮,故D选项正确。
本题难度:一般
5、选择题 几种短周期元素的原子半径及主要化合价如下表,下列叙述不正确的是( )
元素代号
| X
| Y
| Z
| W
| V
|
原子半径/nm
| 0.090
| 0.118
| 0.075
| 0.073
| 0.102
|
主要化合价
| +2
| +3
| +5、+3、-3
| -2
| +6、-2
|
A.X、Z、W位于同周期,Y与V位于同周期
B.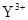 与
与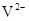 的核外电子数相等
的核外电子数相等
C.Y与W形成的化合物具有两性
D.Z的氢化物可与V的最高价氧化物的水溶液反应生成盐
参考答案:B
本题解析:分析表中数据得:W为O元素,V为S元素,Z为N元素,Y为Al元素,X为Be元素。
B、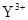 与
与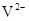 的核外电子数分别为10个、18个,故错;故选B。
的核外电子数分别为10个、18个,故错;故选B。
点评:本题考查元素位置结构和性质的关系及应用,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键。
本题难度:简单