1、选择题 短周期元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列说法不正确的是?
A.X是钠元素
B.离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最强
D.同周期元素中Y的非金属性最强
2、选择题 2006年12月1日为世界第19个艾滋病日,联合国艾滋病规划署确定的宣传主题是“遏制艾滋,履行承诺”。医学界通过用放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是( )
A.14C原子与C60中普通碳原子的化学性质不同
B.14C原子与14N原子所含中子数相同
C.是C60的同素异形体
D.与12C、13C是碳元素的三种同位素
3、填空题 下表为元素周期表的一部分,参照元素①~⑧在表中的位置,用化学用语 回答下列问题:
回答下列问题:

(1)④、⑤、⑦形成的简单离子的半径由大到小的顺序是____________________。
(2)含 ⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量
⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量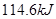 ,此反应的热化学方程式为____________________。
,此反应的热化学方程式为____________________。
(3)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为______________________________。
N ⑥的单质的化学方程式为________________________________________。
⑥的单质的化学方程式为________________________________________。
M溶液中离子浓度由大到小的顺序为________________________________________。
(4)设计实验探究⑧、⑨两种元素非金属性的相对强弱。
可选用的试剂有:氯水、 溶液、
溶液、 溶液、
溶液、 。
。
请完成实验 报告单:
报告单:
实验内容
| 现象
|
步骤一:试管1:取少量氯水:试管2:取少量 溶液,滴加少量氯水。 溶液,滴加少量氯水。
| 试管2中的现象是:____________________
|
步骤二:分别向试管1、试管2中 加入试剂________,振荡。
| 试管2中的现象是_________________
|
①试管1的作用是________________________________。
②实验结论是____________________________________________,产生该结论的原因是:同主族元素从上到下________,得电子能力逐渐减弱。
4、选择题 下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是
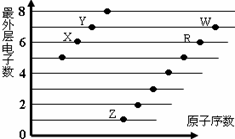
A.该图体现出原子核外电子层呈现周期性变化
B.原子半径:W>R>X
C.W的氢化物与R的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W
D.R、Z形成的化合物中可能含有共价键
5、选择题 由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种以上元素,它们的分子质子总数均与氩原子相同。已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是?(?)
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第二周期IV A族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
|