1、选择题 短周期元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列说法不正确的是?
A.X是钠元素
B.离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最强
D.同周期元素中Y的非金属性最强
参考答案:B
本题解析:X、Y在同一周期,只可能为二、三周期。X+与Z2-具有相同的核外电子层结构,说明X比Z多一个电子层,所以X、Y为第三周期元素,Z为第二周期元素,X为Na,Y为Cl、Z为O。根据元素周期律分析,电子层数相同,原子序数越大,离子半径越小,B错误。
本题难度:一般
2、选择题 2006年12月1日为世界第19个艾滋病日,联合国艾滋病规划署确定的宣传主题是“遏制艾滋,履行承诺”。医学界通过用放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是( )
A.14C原子与C60中普通碳原子的化学性质不同
B.14C原子与14N原子所含中子数相同
C.是C60的同素异形体
D.与12C、13C是碳元素的三种同位素
参考答案:D
本题解析:14C属于碳元素的一种同位素,它原子核内有6个质子、8个中子,而14N的中子数为7;C60属于单质,与14C无法放在同一范畴;只要是碳原子,它们的化学性质就应该相同。
本题难度:简单
3、填空题 下表为元素周期表的一部分,参照元素①~⑧在表中的位置,用化学用语 回答下列问题:
回答下列问题:

(1)④、⑤、⑦形成的简单离子的半径由大到小的顺序是____________________。
(2)含 ⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量
⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量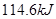 ,此反应的热化学方程式为____________________。
,此反应的热化学方程式为____________________。
(3)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为______________________________。
N ⑥的单质的化学方程式为________________________________________。
⑥的单质的化学方程式为________________________________________。
M溶液中离子浓度由大到小的顺序为________________________________________。
(4)设计实验探究⑧、⑨两种元素非金属性的相对强弱。
可选用的试剂有:氯水、 溶液、
溶液、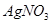 溶液、
溶液、 。
。
请完成实验 报告单:
报告单:
实验内容
| 现象
|
步骤一:试管1:取少量氯水:试管2:取少量 溶液,滴加少量氯水。 溶液,滴加少量氯水。
| 试管2中的现象是:____________________
|
步骤二:分别向试管1、试管2中加入试剂________,振荡。
| 试管2中的现象是_________________
|
①试管1的作用是________________________________。
②实验结论是____________________________________________,产生该结论的原因是:同主族元素从上到下________,得电子能力逐渐减弱。
参考答案:(1)
(2)  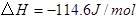
 ?(3) ?(3)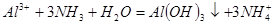

(4)
?
无色溶液变黄

溶液分层,下层橙色
①对比实验?② 的金属性比 的金属性比 强,原子半径增大 强,原子半径增大
本题解析:略
本题难度:一般
4、选择题 下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是
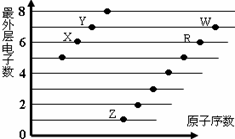
A.该图体现出原子核外电子层呈现周期性变化
B.原子半径:W>R>X
C.W的氢化物与R的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W
D.R、Z形成的化合物中可能含有共价键
参考答案:D
本题解析:A.该图体现出原子核外最外层电子数呈现周期性变化。错误。B.W、R是同一周期的元素,原子序数越大,原子半径越小;X的原子核外电子层数比W、R少一层,一层原子半径比它们小。故原子半径:R>W>X。错误。C.W的氢化物与R的氢化物稳定性W>R,所以元素的非金属性W>R。错误。D.R最外层有6个电子是S元素; Z最外层有1个电子,是Na,二者形成的化合物Na2SO3中含有离子键、共价键。正确。
本题难度:一般
5、选择题 由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种以上元素,它们的分子质子总数均与氩原子相同。已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是?(?)
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第二周期IV A族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
参考答案:D
本题解析:A选项,甲是18电子的氢化物,且其水溶液为二元弱酸,不难得出甲为H2S,某钠盐溶液若为NaHS溶液,其中含有HS-、OH-,但NaHS既能与盐酸等反应生成H2S,也能与Na0H反应生成Na2S,故A错误;B选项,氧气的摩尔质量为32g/mol,乙的摩尔质量也为32g/mol,且含有18电子,CH3 OH符合,CH3 OH中只含有极性键无非极性键,故B错误;C选项,第二周期IVA族元素为C,如CH3 OH符合,但CH3 OH不是CH4的同系物,故C错误;D选项,H2S中元素的质量比为1:16,H2O2分子中元素的质量比也为1:16,H2O2中氧元素的价态为一1价,故D正确
本题难度:一般
|