1、选择题 在Cu2S + 2Cu2O =6Cu + SO2↑反应中,下列说法正确的是?(?)
A.生成1molCu,转移2mol电子
B.Cu是氧化产物
C.Cu2S既是氧化剂又是还原剂
D.氧化剂只有Cu2O
参考答案:C
本题解析:根据方程式可知,Cu2S中Cu的化合价从+1价降低到0价,S的化合价从-2价升高到+4价,所以Cu2S既是氧化剂,也是还原剂。Cu2O中Cu的化合价从+1价降低到0价,因此Cu2O是氧化剂。所以选项BD是错误的,C正确。A不正确,生成1molCu,转移1mol电子,答案选C。
本题难度:简单
2、选择题 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:
①Cu与HNO3溶液
②Cu与FeCl3溶液
③Zn与H2SO4溶液
④Fe与HCl溶液,
由于溶液浓度不同而能发生不同氧化还原反应的是
[? ]
A.①③
B.③④
C.①②
D.①④
参考答案:A
本题解析:
本题难度:一般
3、填空题 (8分)亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:
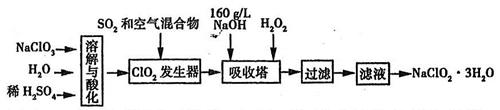
(1)C1O2发生器中所发生反应的离子方程式为?,发生器中鼓入空气的作用可能是?(选填序号)。
A.将SO2氧化成SO3增强酸性
B.稀释C1O2以防止爆炸?
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450mLl60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是?g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有?
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是?
(4)在吸收塔中,可代替H2O2的试剂是??(填序号)。
A.Na2O2? B.Na2S? C.FeCl2? D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是?(填操作名称)
参考答案:
(1)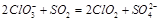 ? (2分)? B(1分)
? (2分)? B(1分)
(2)80.0(1分)? 500ml容量瓶?胶头滴管(1分)
(3)酚酞溶液或 溶液等(1分)?(4)A(1分)
溶液等(1分)?(4)A(1分)
(5)加热浓缩、冷却结晶、过滤(1分)
本题解析:
(1)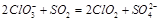 ?,ClO3-中氯元素为+5价,遇到具有还原性的SO2反应做氧化剂,化合价降低,根据图意生成ClO2,而SO2中S价态升高,生成SO42-;鼓入空气的作用是稀释ClO2,而A的反应需要加催化剂,而C选项,需要还原剂。
?,ClO3-中氯元素为+5价,遇到具有还原性的SO2反应做氧化剂,化合价降低,根据图意生成ClO2,而SO2中S价态升高,生成SO42-;鼓入空气的作用是稀释ClO2,而A的反应需要加催化剂,而C选项,需要还原剂。
(2)根据公式计算,m=n*M=C*V*M=80g?;容量瓶必须标明量程。而没有标准的450ml的容量瓶,而选用500ml配置。胶头滴管用于定容。
(3)检验碱是否过量用酸碱指示剂,或者用氢氧化铁,现象为有红褐色沉淀。
(4)在吸收塔中需要氧化剂,过氧化钠与双氧水氧化性能相似。
(5)从溶液中得到晶体的一般过程为加热浓缩,冷却结晶,过滤。
点评:本题综合性比较强,结合化工生产的流程图,所考查的知识点不难,知识点比较零散,需要学生有较强的知识基础和综合能力。
本题难度:困难
4、选择题 三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
①?C3N3(OH)3 3HNCO
3HNCO
②?8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O
(两个方程式中所有碳元素的化合价均为+4)
下列说法正确的是
A.反应①、②均是氧化还原反应
B.反应②中N2既是氧化产物、又是还原产物
C.反应②中,每转移1mol电子,NO2被氧化0.25 mol
D.反应②中氧化剂、还原剂的物质的量之比为4∶3
参考答案:B
本题解析:
正确答案:B
A.不正确,反应②是氧化还原反应,①是非氧化还原反应;
B.正确,反应②中N 从-3价和+4价均变成0价, N2既是氧化产物、又是还原产物
C.不正确,反应②中,每转移1mol电子,NO2中氮降4价,NO2被还原0.25 mol
D.不正确,反应②中氧化剂、还原剂的物质的量之比为6:8=3∶4
本题难度:简单
5、选择题 人体正常的血红蛋白中应含Fe2+。若误食亚硝酸盐,则导致血红蛋白中的Fe2+转化为高铁(Fe3+)血红蛋白而中毒。服用维生素C可解除亚硝酸盐中毒。下列叙述中正确的是(? )
A.亚硝酸盐是还原剂
B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐被氧化
参考答案:C
本题解析:Fe3+的化合价降低,被还原,维生素C作为还原剂。
本题难度:简单