1、选择题 下列各组离子能在溶液中大量共存的是
A.H+、Ca2+、NO3-、CO32-
B.K+、Na+、Br-、NO3-
C.Ag+、Na+、Cl-、K+
D.Cu2+、K+、NO3-、OH-
2、选择题 已知在常温下,测得浓度均为0.1?mol/L的下列六种溶液的pH
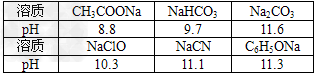
复分解反应存在一个规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列离子反应不能成立的是
[? ]
A.CO32-+C6H5OH→HCO3-+C6H5O-
B.CO2+H2O+ClO-===HCO3-+HClO
C.CO2+H2O+C6H5O-→HCO3-+C6H5OH
D.CO2+H2O+2C6H5O-→CO32-+2C6H5OH
3、填空题 A、B、C、D、E均为可溶于水的固体,组成他们的离子有
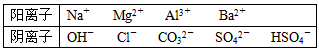
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是A_________;B_________;C_________;D_________;E_________。
4、填空题 (9分)某中学化学兴趣小组在课外活动时,对学校附近的甲、乙两条河流的水质进行了多次检测。第一组检测甲河流的水质结果如下:
检测次数
| 溶液中检测出的溶质
|
?第一次
| KCl? K2SO4?Na2CO3? NaCl
|
?第二次
| KCl? BaCl2? Na2SO4?K2CO3
|
?第三次
| Na2SO4?KCl? K2CO3?NaCl
|
(1)三次检测结果中第??次的结果肯定不正确。
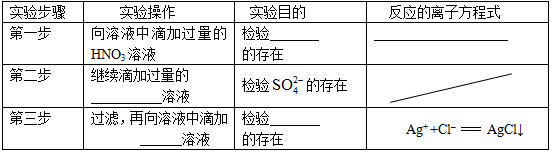
(2)在检测时,为了确定溶液中是否存在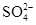 、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
(3)第二组对乙河流进行检测,乙河流两边有甲、乙两工厂,经检测它们排放的工业废水中共含有K+、Ag+、Fe3+、、Cl–、OH–、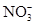 六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为?、?、?。
六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为?、?、?。
5、选择题 下列离子方程式中书写正确的是
A.氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O
B.碳酸钙和盐酸反应:
C.硫酸溶液和氢氧化钡溶液:
D.硝酸银溶液与氯化钠溶液反应:Ag++Cl-=AgCl↓