1、选择题 下列各组离子能在溶液中大量共存的是
A.H+、Ca2+、NO3-、CO32-
B.K+、Na+、Br-、NO3-
C.Ag+、Na+、Cl-、K+
D.Cu2+、K+、NO3-、OH-
参考答案:B
本题解析:分析:根据离子之间不能结合生成水、气体、沉淀等,则离子能大量共存,以此来解答.
解答:A.因Ca2+、CO32-结合生成沉淀,H+、CO32-结合生成水和气体,则不能共存,故A错误;
B.因该组离子之间不反应,能共存,故B正确;
C.因Ag+、Cl-结合生成沉淀,则不能共存,故C错误;
D.因Cu2+、OH-结合生成沉淀,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,熟悉复分解反应发生的条件即可解答,注意物质的溶解性,题目较简单.
本题难度:简单
2、选择题 已知在常温下,测得浓度均为0.1?mol/L的下列六种溶液的pH
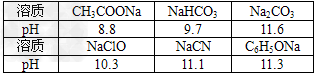
复分解反应存在一个规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列离子反应不能成立的是
[? ]
A.CO32-+C6H5OH→HCO3-+C6H5O-
B.CO2+H2O+ClO-===HCO3-+HClO
C.CO2+H2O+C6H5O-→HCO3-+C6H5OH
D.CO2+H2O+2C6H5O-→CO32-+2C6H5OH
参考答案:D
本题解析:
本题难度:一般
3、填空题 A、B、C、D、E均为可溶于水的固体,组成他们的离子有
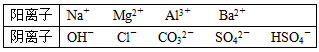
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是A_________;B_________;C_________;D_________;E_________。
参考答案:Na2CO3;Al2(SO4)3;MgCl2;Ba(OH)2;NaHSO4[Mg(HSO4)2]
本题解析:
本题难度:一般
4、填空题 (9分)某中学化学兴趣小组在课外活动时,对学校附近的甲、乙两条河流的水质进行了多次检测。第一组检测甲河流的水质结果如下:
检测次数
| 溶液中检测出的溶质
|
?第一次
| KCl? K2SO4?Na2CO3? NaCl
|
?第二次
| KCl? BaCl2? Na2SO4?K2CO3
|
?第三次
| Na2SO4?KCl? K2CO3?NaCl
|
(1)三次检测结果中第??次的结果肯定不正确。
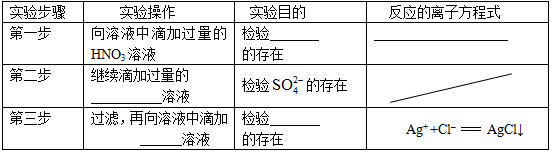
(2)在检测时,为了确定溶液中是否存在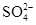 、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
(3)第二组对乙河流进行检测,乙河流两边有甲、乙两工厂,经检测它们排放的工业废水中共含有K+、Ag+、Fe3+、、Cl–、OH–、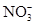 六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为?、?、?。
六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为?、?、?。
参考答案:(1)二(2)①CO32–?2H++CO32-="=" H2O + CO2 ↑ ?② Ba(NO3)2? ③AgNO3 ?Ag+ ?
(3)OH-? K+? Cl-
本题解析:(1)由于Ba2+和SO42-不共存,所以二组一定是错误的。(2)向溶液中滴加过量的HNO3溶液,检验CO32-离子是否存在,反应的离子方程式为:2H++CO32-="=" H2O + CO2↑,检验SO42-离子的存在要加Ba(NO3)2,检验Cl-的存在要加入AgNO3。(3)因为甲厂的废水明显呈碱性,所以有OH-存在,不能与OH-共存的离子有Ag+、Fe3+,而与Ag+、Fe3+共存的离子有NO3-,这三种离子应该在乙厂废水中含有,所以甲厂排放的离子有OH-? K+? Cl-。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
5、选择题 下列离子方程式中书写正确的是
A.氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O
B.碳酸钙和盐酸反应:
C.硫酸溶液和氢氧化钡溶液:
D.硝酸银溶液与氯化钠溶液反应:Ag++Cl-=AgCl↓
参考答案:D
本题解析:分析:A、不是氧化还原反应,生成的产物是亚铁离子,不是铁离子;
B、碳酸钙是难溶物,应该写成化学式,不能写成离子形式;
C、反应还原弱电解质水生成,不能漏掉;
D、阳离子和氯离子生成氯化银沉淀.
解答:A、生成的产物应该是亚铁离子,正确离子方程式是:FeO+2H+=Fe2++H2O,故A错误;
B、碳酸钙是难溶物,应该写成化学式,正确的离子方程式是:CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C、漏掉了弱电解质水,正确的离子方程式是:SO42-+2H++Ba2+2OH-═BaSO4↓+2H2O,故C错误;
D、硝酸银和氯化钠反应的离子方程式是:Ag++Cl-=AgCl↓,故D正确;
故选D.
点评:本题考查了离子方程式的书写,注意不要漏项、难溶物、弱电解质写成化学式,本题难度不大.
本题难度:简单