1、选择题 热化学方程式中的化学计量数表示( )
A.分子个数
B.原子个数
C.物质的质量
D.物质的量
参考答案:D
本题解析:
本题难度:简单
2、填空题 已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃
| 700
| 900
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
|
回答下列问题:
(1)该反应的 △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率会 (填“变大”、“变小”或“不变”)
(3)若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
a.单位时间里生成B和D的物质的量相等
b.气体的密度不随时间改变
c.容器内压强保持不变
d.混合气体的平均摩尔质量保持不变
(4)1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
参考答案:(1)<(2)80%;不变(3)a(4)2.5
本题解析:(1)通过平衡常数和温度的关系:平衡常数随温度增加而减少,根据勒夏特列原理,温度升高,平衡向吸热反应方向进行,因此 △H<0;
(2)设消耗A的物质的量为x
A(g) + B(g)  C(g)+D(g)
C(g)+D(g)
起始物质的量: 0.20 0.80 0 0
变化的物质的量:x x x x
平衡物质的量:0.20-x 0.80-x x x
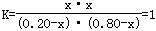 ,解得x=0.16,A的转化率=
,解得x=0.16,A的转化率=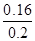 ×100%=80%
×100%=80%
等温等容下,充入非反应气体,各组分浓度不变,平衡不移动,A的转化率不变。
(3)a、单位时间内生成B和D的物质的量相等,说明生成B和D的速率相等,生成B和D的方向是一正一逆,能够作为达到化学平衡的标志;b、ρ= ,反应物和生成物都是气体,m不变,是等容的容器的v不变,因此反应的任何时刻ρ不变,不能作为达到化学平衡的标志;c、反应前后气体系数之和不变,压强在任何时刻不变,不能作为达到互学平衡的标志;d、M=
,反应物和生成物都是气体,m不变,是等容的容器的v不变,因此反应的任何时刻ρ不变,不能作为达到化学平衡的标志;c、反应前后气体系数之和不变,压强在任何时刻不变,不能作为达到互学平衡的标志;d、M= ,M反应任何时刻不变,不能作为达到化学平衡的标志。(4)1200 ℃时反应C(g)+D(g)
,M反应任何时刻不变,不能作为达到化学平衡的标志。(4)1200 ℃时反应C(g)+D(g)  A(g)+B(g),
A(g)+B(g), 。
。
考点:考查化学平衡常数、判断达到化学平衡的标志。
本题难度:困难
3、选择题 已知1gH2燃烧生成液态水时放出142.9kJ的热量,以下热化学方程式正确的是( ? )
A.2H2(g)+O2(g)=2H2O(l)△H=-142.9kJ?mol-1
B.2H2(g)+O2(g)=2H2O(l)△H=+571.6kJ?mol-1
C.2H2+O2=2H2O△H=-571.6kJ?mol-1
D.H2(g)+ O2(g)=H2O(l)△H=-285.8kJ?mol-1
O2(g)=H2O(l)△H=-285.8kJ?mol-1
参考答案:D
本题解析:
本题难度:一般
4、选择题 同温同压下,已知下列各反应为放热反应,下列各热化学方程式中热量数值最小的是
[? ]
A.2A ( l ) + B ( l ) = 2C (g ) △H1
B.2A ( g ) + B ( g ) = 2C (g ) △H2
C.2A ( g ) + B ( g ) = 2C ( l ) △H3
D.2A ( l ) + B ( l ) = 2C ( l ) △H4
参考答案:A
本题解析:
本题难度:简单
5、选择题 已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-Q1 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH3=-Q2kJ·mol-1
取体积比2∶3的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2
B.0.2Q1+0.05Q2
C.0.2Q1+0.15Q2
D.0.2Q1+0.3Q2