1、选择题 下列物质熔化时,化学键没有被破坏的是(?)A
A.冰
B.氢氧化钠
C.氯化钠
D.硫酸铵
参考答案:A
本题解析:略
本题难度:简单
2、推断题 A,B,C,D,E,F6种短周期元素的原子序数依次增大。已知A,C,F3种原子的最外层共有11个电子,且这3 种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A____,D____,E____。
(2)用电子式表示B,F形成的化合物________。
(3)A,C两种元素最高价氧化物对应水化物之间反应的离子方程式为:________________________。
参考答案:(l)Na;Si;P
(2)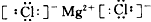
(3)Al(OH)3+OH-==AlO2-+2H2O
本题解析:
本题难度:一般
3、选择题 有四组同族元素的物质,在101.3kPa时测定它们的沸点(℃)如表所示:
| 第一组 | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7
第二组
F2-187.0
Cl2-33.6
(b)?58.7
I2?184.0
第三组
(c)?19.4
HCl-84.0
HBr-67.0
HI-35.3
第四组
H2O?100.0
H2S-60.2
(d)-42.0
H2Te-1.8
|
下列各项中正确的是( )
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列各组物质各自形成的晶体,均属于分子晶体的化合物的是(?)。
A.NH3、HD、C10H8?B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5?D.CCl4、Na2S、H2O2
参考答案:B
本题解析:A中HD是单质不是化合物。C中SiO2是原子晶体,不是分子晶体。D中Na2S是离子晶体,不是分子晶体。
本题难度:一般
5、简答题 A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E顺序依次增大,C、D都能分别与A按原子个数比为1:1或2:1形成化合物,CB的水溶液不能放在玻璃容器中,A、E可形成化学式为EA2、EA3两种化合物,它们都可与D的最高价氧化物的水化物反应.
(1)D在周期表中的位置为______;
(2)C与A形成的化合物中,既有极性键又有非极性键的化合物的化学式为______;
(3)写出E的气态氢化物与少量D的最高价氧化物的水化物反应的离子方程式______;
(4)在上述元素中,选择相同元素组成两种化合物X、Y.
①若混合X,Y的水溶液能发生反应,写出离子方程式______;
②若X呈碱性,在空气中久置会变成Y,写出X的化学式______;
若X呈酸性,在空气中久置会变成Y,写出X的名称______
(5)DC与C2A反应的化学方程为______.
参考答案:短周期元素,核电荷数按C、A、B、D、E顺序依次增大,C、D都能分别与A按原子个数比为1:1或2:1形成化合物,则C为H,A为O,D为Na;CB的水溶液不能放在玻璃容器中,即CB为HF,所以B为F;A、E可形成化学式为EA2、EA3两种化合物,它们都可与D的最高价氧化物的水化物反应,则E有+4、+6价,所以E为S;
(1)D为Na,原子序数为11,原子结构中有3个电子层,最外层电子数为1,则位于元素周期表中第三周期IA族,
故答案为:第三周期IA族;
(2)C与A形成的化合物有H2O、H2O2,但水中只有极性键,H2O2中既有极性键(H-O),又有非极性键(O-O),
故答案为:H2O2;
(3)E的气态氢化物为H2S,溶液显酸性,与碱发生中和反应,D的最高价氧化物的水化物为NaOH,碱少量时该离子反应为
H2S+OH-═HS-+H2O,故答案为:H2S+OH-═HS-+H2O;
(4)①选择Na、H、O、S元素,则硫酸氢钠与亚硫酸氢钠反应生成硫酸钠、二氧化硫和水,
离子反应为H++HSO32-═SO2+H2O,故答案为:H++HSO32-═SO2+H2O;
②亚硫酸钠溶液显碱性,且亚硫酸钠易被氧化,亚硫酸钠的化学式为Na2SO3,又亚硫酸为酸,易被氧化为硫酸,
故答案为:Na2SO3;亚硫酸;
(5)NaH中H元素为-1价,水中H元素为+1价,二者发生氧化还原反应,该反应为NaH+H2O═H2+NaOH,
故答案为:NaH+H2O═H2+NaOH.
本题解析:
本题难度:一般