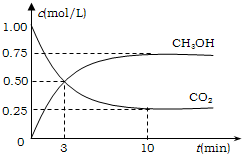
1、填空题 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L?min);
②氢气的转化率=______;
③该反应的平衡常数为______(保留小数点后2位);
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是______.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1molCO2和3molH2.
参考答案:(1)①利用三段式解题法计算
CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 30 0
变化(mol/L):0.75 2.250.75 0.75
平衡(mol/L):0.25 0.75 0.750.75
从反应开始到平衡,氢气的平均反应速率v(H2)=2.25mol/L10min=0.225mol?L-1?min-1,
故答案为:0.225;
②氢气的转化率=2.253×100%=75%,
故答案为:75%;
②平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=c(CH3OH)c(H2O)c(CO2)c3(H2)=0.75×0.750.25×0.753=5.33,
故答案为:5.33;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1molCO2和3molH2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD.
本题解析:
本题难度:一般
2、选择题 反应N2O4(g)  2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是(?)
2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是(?)

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a浅,c深
C.b、c两点的转化率:b>c
D.由b点到a点,可以用加热的方法
参考答案:D
本题解析:根据图像可知,a、c两点都在等温线上,a点压强小于c点压强,所以c点反应速率大于a点反应速率,A不正确;正方应是体积减小的可逆反应,则增大压强平衡向逆反应方向移动,NO2的浓度降低,颜色变浅,B不正确;b、c两点的NO2含量相同,转化率相同,C不正确。由b点到a点,NO2的含量增大,说明平衡向正反应方向移动。易于正方应是吸热反应,所以可以用加热的方法,D正确,答案选D。
点评:该题是中等难度的试题,主要是考查学生对可逆反应图像识别的掌握情况,意在培养学生的逻辑推理能力,提升的学生的学科素养。该题的关键是明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答。
本题难度:一般
3、选择题 在某恒容的密闭容器中,可逆反应A(g)+B(g)  ?xC(g)有如图所示的关系曲线,下列说法正确的是(?)
?xC(g)有如图所示的关系曲线,下列说法正确的是(?)
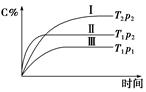
A.温度:T1>T2
B.压强:p1>p2
C.正反应是吸热反应
D.x的值是2
参考答案:A
本题解析:根据曲线Ⅰ和曲线Ⅱ可知,曲线Ⅱ先达到平衡,则T1>T2,升高温度,C%减小,说明正反应为放热反应,A对、C错;根据曲线Ⅱ和曲线Ⅲ可知,曲线Ⅱ先达平衡,说明压强p2>p1,增大压强,C%增加,说明平衡向正反应方向移动,x=1,B错、D错。
本题难度:一般
4、选择题 对于反应A(g)+3B(g)  2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
[? ]
A、v(A)=0.01 mol/(L·s)
B、v(B)=0.02 mol/(L·s)
C、v(B)=0.60mol/(L·min)
D、v(C)=1.0mol/(L·min)
参考答案:A
本题解析:
本题难度:简单
5、选择题 下列说法可以证明反应N2 + 3H2 2NH3,已达平衡状态的是( )
2NH3,已达平衡状态的是( )
A.1个N≡N键断裂的同时有6个H-N键形成
B.1个N≡N键断裂的同时有3个H-H键形成
C.容器内各物质的浓度相等
D.容器内N2、H2、NH3的速率之比为1:3:2
参考答案:B
本题解析:A中均表示υ(正),故错误;
B、υ(N2,正):υ(H2,逆)=1:3,故正确;
各组分浓度为定值,但不一定相等,故C错误;
要用速率判断是否达平衡状态,得能表明正、逆反应,而D中未指明,故错误;
本题难度:一般