1、简答题 在一个固定的反应器中,有一可以自由滑动的密封隔板,两侧分别进行如图所示的化学反应(均加有适量的新型固体催化剂,体积忽略).
| 2SO2(g)+O2(g)?2SO3(g) | N2(g)+3H2(g)?2NH3(g)
|
(1)若起始时左侧投入2molSO2、1molO2,右侧投入1molN2、4molH2,达到平衡后,隔板是否可能处于正中间?______(填“可能”或“不可能”),原因是______.
(2)若起始时左侧投入2molSO2、1molO2,右侧投入1molN2、2molH2,达到平衡后,隔板处于正中间,则SO2转化率与N2转化率之比为______.
(3)若起始时左侧投入2molSO2、1molO2,右侧投入1molN2、amolH2、0.1molNH3且起始时右侧体积小于左侧体积,达到平衡后,调节反应温度至某一温度(两侧温度相同),使达到平衡后,隔板处于正中间,此时SO2转化率与N2转化率之比为5:1,求a的取值范围______.
参考答案:(1)隔板处于中央,则左、右两室中混合气体的总物质的量相等,若右室中氮气完全转化时,右室中混合气体物质的量达极小值,
N2(g)+3H2(g)?2NH3(g) 物质的量减小
1 1+3-2=2
1mol 2mol
故若右室中氮气完全转化,混合气体物质的量=1+4mol-2mol=3mol,左室中没有反应时,混合气体总物质的量为3mol,故平衡时,右室中气体总物质的量大于左室,隔板不可能处于中央,
故答案为:不可能;因为左侧反应达到平衡时气体体积2<V<3,右侧反应达到平衡时气体体积3<V<5,两边体积没有相等的可能,隔板不会处于正中间;
(2)达到平衡后,隔板仍处于中央,则左、右两室中混合气体的总物质的量相等,即左、右两室混合气体物质的量减少量相等,假定减少量为ymol,则:
左室:2SO2(g)+O2(g)?2SO2(g) 物质的量减小
2 1
2ymol ymol
右室:N2(g)+3H2(g)?2NH3(g) 物质的量减小
1 2
0.5y mol ymol
故SO2与N2转化率之比=2Ymol2mol:0.5Ymol1mol=2:1,
故答案为:2:1;
(3)起始时右侧体积小于左侧体积,则右室混合气体总物质的量小于左室中混合气体总物质的量,则:2mol+1mol>1mol+amol+0.1mol,解得a<1.9,
左右两侧反应都达到平衡,且平衡时隔板处于中央,则左、右两室中混合气体的总物质的量相等,令氮气的转化率为b,则二氧化硫转化率为5b,则:
左室:2SO2(g)+O2(g)?2SO2(g) 物质的量减小
2 1
2mol×5b5bmol
右室:N2(g)+3H2(g)?2NH3(g) 物质的量减小
13 2
bmol3b2bmol
所以,2mol+1mol-5bmol=1mol+amol+0.1mol-2bmol,故1.9-3b=a,由于是可逆反应,故5b×2<2、b×3<a,联立得a>1.3,
综上所述,可得1.3<a<1.9,
故答案为:1.3<a<1.9.
本题解析:
本题难度:简单
2、填空题 (11分)(1)一定温度下,在恒容密闭容器中N2O5可发生下 列反应:2N2O5(g)
列反应:2N2O5(g)  4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将?(填“增大”、
“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
t/s
| 0
| 500
| 10 00 00
|
c(N2O5)/mol·L—1
| 5.00
| 3.52
| 2.48
|
则500s内N2O5的分解速率为?。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2?T1。(填“>”、“<” 或 “ =”)
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的?区 (填“阳极”或“阴极”)生成,其电极反应式为?。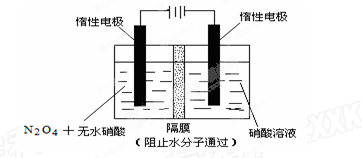
参考答案:1)不变? 2分? 0.00296 mol·L—1·s—1? 2分?<或小于 2分
(2)阳极2分? N2O4+2HNO3—2e—=2N2O5+2H+?3分
本题解析:略
本题难度:一般
3、选择题 在水溶液中,重铬酸钾K2Cr2O7存在以下平衡: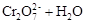

 ,下列说法正确的是
,下列说法正确的是
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应不是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是
参考答案:BC
本题解析:A、向该溶液中加入过量浓NaOH溶液,平衡向右移动,重铬酸根的浓度减小,铬酸根浓度增大,溶液呈黄色,错误;B、该反应没有元素化合价变化,不是氧化还原反应,正确;? C、向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,减弱氢离子浓度的增大而不能抵消,氢离子浓度比原溶液大,正确;D、该反应为水溶液中进行的反应,溶剂水不写入平衡常数表达式,错误。
本题难度:一般
4、选择题 在一定温度下将1 mol CO和1 mol水蒸气放入一固定容积的密闭容器中,反应CO(g)+H2O(g)? ?CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
?CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
A.0.9 mol
B.0.8 mol
C.0.7 mol
D.0.6 mol
参考答案:C
本题解析:根据平衡时生成0.6molCO2可知,水蒸气的转化率是60%。再加入0.3mol水蒸气,则平衡向正反应方向进行,因此CO2的物质的量大于0.6mol,但水蒸气的转化率降低,所以平衡时生成的CO2最多是0.6×1.3mol=7.8mol,因此答案选C。
本题难度:一般
5、填空题 (14分)如图的甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1 mol A、3 mol B,此时两容器体积均为500 mL,温度为T℃。保持温度不变,发生反应A(g)+3B(g) 2C(g)+D(s);△H<0。
2C(g)+D(s);△H<0。
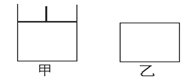
 (1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
A.混合气体的总质量不随时间改变? B.2 v正(C)=3 v逆(B)
C.A、B转化率相等? D. 物质D的质量不随时间改变
(2)2 min后甲容器中的化学反应达到平衡, 测得C
测得C 的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
(3)乙容器中反应 达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α
达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α 乙(B) ______α甲(B) (填“>、<或=”)。
乙(B) ______α甲(B) (填“>、<或=”)。
(4)若其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n (D)应该满足的条件为________________________。
参考答案:(14分)
(1)A D
(2)400,40%
(3)>、<
(4)2,n (D)>0.6 mol
本题解析:略
本题难度:一般