1、选择题 在烧杯中加水和苯(密度:0.88 g/cm3)各50 mL。将一小粒金属钠(密度:0.97 g/cm3)投入烧杯中。观察到的现象可能是
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并可能作上、下跳动
参考答案:D
本题解析:此题考查的面很广,首先是苯与水互不溶解,还有钠的密度处于苯和水之间,钠能与水中的氢反应而不与苯中的氢反应。另外钠与水反应放出的氢气使钠在苯与水的界面处反应并可能作上、下跳动。
本题难度:简单
2、实验题 碱金属与O2反应生成的氧化物比较复杂:有普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3。其中后三种均可与水或CO2反应生成氧气。要制备普通氧化物,一般要用碱金属单质还原对应的过氧化物、硝酸盐或亚硝酸盐。
(1)用化学反应方程式表示①钠与Na2O2反应__________________________。②钾与硝酸钾反应:_____________________。③RbO3与CO2反应:______________________________。
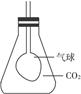
(2)若用锥形瓶收集一瓶CO2气体,在瓶内有一只扎紧在玻璃管末端的气球,如下图。打开塞子迅速往瓶里加入一种物质后,立即塞紧塞子,一段时间后气球就会自动膨胀,该物质可能是
A.Na2O
B.Na2O2
C.KO2
D.RbO3
参考答案:(1)①2Na+Na2O2====2Na2O?②10K+2KNO3====6K2O+N2↑?
③4RbO3+2CO2====2Rb2CO3+5O2
(2)AB
本题解析:(1)①钠具有还原性,Na2O2具有氧化性,二者可发生如下反应:
2Na+Na2O2====2Na2O
②同理根据题设,钾与硝酸钾反应时生成单质,则反应为10K+2KNO3====6K2O+N2↑。注意,此反应的最终产物为K2O而不是K2O2,因为K2O2能与K反应生成K2O。
③类比过氧化钠与二氧化碳反应,可得4RbO3+2CO2====2Rb2CO3+5O2。
(2)气球会膨胀,表明瓶内气体压强减小(即气体总体积减小),答案为A、B。
本题难度:简单
3、选择题 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加
HCl溶液的体积之间关系如图所示,下列有关说法不正确的是
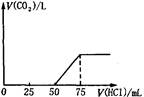
A.A溶液中溶质Na2CO3和NaHCO3物质的量比为1:1
B.A溶液中溶质NaOH和Na2CO3物质的量比为1:1
C.原NaOH溶液物质的量浓度为0.075mol/L
D.通入CO2气体在标况下的体积为56mL
参考答案:A
本题解析:
CO2与NaOH溶液反应有如下两种“边界”情况:
CO2+2NaOH=Na2CO3+H2O…①
CO2+NaOH=NaHCO3…②
故反应后溶液中溶质的成分可有如下可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:
Na2CO3+HCl=NaHCO3+NaCl…③
NaHCO3+HCl=NaCl+H2O+CO2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等.
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤
设反应产生CO2之前消耗盐酸的体积为V1,从开始产生CO2至反应结束消耗盐酸的体积为V2.
将各种反应的情况总结如下表:
溶液中溶质的成分
Na2CO3和NaOH
Na2CO3
Na2CO3和NaHCO3
NaHCO3
NaHCO3
向溶液中逐滴加入稀盐酸发生的反应
依次是⑤③④
依次是③④
依次是③④
④
④
V1与V2的关系
V1>V2
V1=V2
V1<V2
V1=0,V2>0
V1=0,V2>0
分析题中的图象:
(1)V1=50mL,V2=75mL-50mL=25mL<V1,据此判断溶液中溶质的成分是Na2CO3和NaOH.
根据上面⑤③④三个化学方程式可知,NaOH和Na2CO3的物质的量之比等于消耗盐酸的体积之比,则
n(NaOH):n(Na2CO3)=(75mL-50mL):25mL=1:1.
故A不正确,B正确;
(2)当加入盐酸75mL时,溶液溶质为NaCl,此时n(Na+)=n(HCl)=0.075mL×0.1mol·L-1=0.0075mol,
所以n(NaOH)=0.0075mol,
c(NaOH)=0.0075mol/0.1L
=0.075mol·L-1,
故C正确;
(3)50mL~75mL发生的反应为HCO3-+H+=H2O+CO2↑,n(HCl)=0.025L×0.1mol·L-1=0.0025mol,
则V(CO2)=0.0025mol×22.4L·mol-1=0.056L=56mL,
故D正确。
选A。
本题难度:简单
4、选择题 在一定温度下,向饱和烧碱溶液中投入一小块金属钠,充分反应后恢复到原来的温度,下列说法正确的是(?)
A.溶液中Na+浓度增大,有H2放出
B.溶液中Na+数目减少,有H2放出
C.溶液中Na+与OH-浓度都增大,有H2放出
D.溶液中OH-数目增大,有H2放出
参考答案:B
本题解析:钠投入溶液后,立即生成NaOH和H2,由于原溶液为饱和溶液,因此在相同条件下,Na+和OH-的浓度不变,但溶剂减少了,Na+与OH-的数目都减少。
本题难度:简单
5、选择题 下列关于钠及其化合物性质的叙述,正确的是
A.钠能与硫酸铜稀溶液反应,置换出红色的铜
B.氧化钠和过氧化钠都能与水反应,生成物完全相同
C.过氧化钠是淡黄色固体,可用作呼吸面具的氧气来源
D.质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,产生气体的质量相同
参考答案:C
本题解析:A.首先发生反应2Na+2H2O=2NaOH+H2↑;然后发生2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.不能置换出Cu。错误。B.Na2O+ H2O=2NaOH;? 2Na2O2+2H2O="4NaOH+" O2↑.反应产物不同。错误。C. 2Na2O2+ 2H2O="4NaOH+" O2↑, 2Na2O2+2CO2 =Na2CO3+ O2.故可以作为氧气的来源。正确。D. Na2CO3+2HCl= 2NaCl+ CO2 ↑ + H2O,106g的Na2CO3产生44g的CO2,NaHCO3+2HCl=NaCl+ CO2 ↑ + H2O,84g的NaHCO3产生44g的CO2,可见质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,产生气体的质量不相同。错误。
本题难度:一般