1、选择题 下列有关NaHCO3和Na2CO3性质的比较中,正确的是(? )
A.热稳定性:Na2CO3<NaHCO3
B.常温时在水中的溶解度:Na2CO3<NaHCO3
C.等质量的NaHCO3和Na2CO3与稀盐酸反应产生CO2的量:Na2CO3<NaHCO3
D.等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2多
参考答案:C
本题解析:
A.不正确,热稳定性:Na2CO3>NaHCO3; B.不正确,常温时在水中的溶解度:Na2CO3>NaHCO3;
C.正确; D.不正确,等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2一样多。选C。
本题难度:简单
2、选择题 下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是
[? ]
A.Na和O2
B.NaOH和CO2
C.Na2O2和CO2
D.木炭(C)和O2
参考答案:C
本题解析:
本题难度:简单
3、选择题
A.42:53
B.53:42
C.26.5:42
D.42:26.5
参考答案:C
本题解析:由2NaHCO3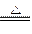 Na2CO3+CO2↑+H2O知:若NaHCO3受热产生11g CO2时则知n(NaHCO3)=0.25mol、生成的n(Na2CO3)= 0.25mol,当0.25mol Na2CO3与足量盐酸反应时就能产生11g CO2,故原混合物中Na2CO3和NaHCO3的物质的量都是0.25mol,其质量比为26.5:42。
Na2CO3+CO2↑+H2O知:若NaHCO3受热产生11g CO2时则知n(NaHCO3)=0.25mol、生成的n(Na2CO3)= 0.25mol,当0.25mol Na2CO3与足量盐酸反应时就能产生11g CO2,故原混合物中Na2CO3和NaHCO3的物质的量都是0.25mol,其质量比为26.5:42。
本题难度:简单
4、选择题 过氧化氢俗称双氧水,它易分解为水和氧气,常作氧化剂、漂白剂和消毒剂,为贮存、运输、使用的方便,工业常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是 (?)
A.MnO2
B.稀盐酸
C. Na2CO3
D.H2S
参考答案:C
本题解析:该晶体具有Na2CO3和H2O2的双重性质,所以在二氧化锰的作用下,能发生分解反应,能氧化H2S。浓盐酸能和Na2CO3反应,而碳酸钠与该物质是不反应的,所以答案选C。
点评:本题主要考查学生的分析能力,以及物质的性质。
本题难度:一般
5、选择题 某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(每次加入的盐酸的物质的量浓度相等),下列分析不正确的是(?)
盐酸 /mL
| 50
| 50
| 50
|
m(混合物)/g
| 9.2
| 15.7
| 27.6
|
V(CO2)(标况)/L
| 2.24
| 3.36L
| 3.36L
|
A.盐酸的物质的量浓度为3.0mol/L
B.根据表中数据能计算混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
参考答案:D
本题解析:NaHCO3+HCl=NaCl+H2O+CO2↑,KHCO3+HCl=KCl+H2O+CO2↑,
A、通过后面的两组数据可以看出,第三组数据中混合物是过量的,盐酸全部参加反应,从上面的方程式可以看出盐酸的物质的量和二氧化碳物质的量是相等的,
二氧化碳物质的量是:3.36/22.4=0.15mol,所以盐酸的物质的量就是0.15mol,摩尔浓度就是:0.15/0.05=3mol/L,故A正确;
B、从前两组中的数据可以看出,二氧化碳的体积增加了1/2,混合物的质量也需要增加1/2,第二组中实际参加反应的混合物是13.8克,15.7克的混合物没有反应完,实际盐酸已经不足了,设碳酸氢钠是x克,则碳酸氢钾就是(13.8-x)克
依据方程式可以看出碳酸氢钠和碳酸氢钾与盐酸物质的量都是1:1,所以碳酸氢钠物质的量是:x/84,碳酸氢钾物质的量是:(13.8-x)/100,x/84 +(13.8-x)/100=0.15,解得:x=6.3克.
质量分数为:6.3/13.8×100%=46%;故B正确
C、从B中的计算可以看出,50ml盐酸会与13.8克的混合物反应,所以9.2克时盐酸过量,故C正确;
D、从前两组中的数据可以看出,二氧化碳的体积增加了1/2,混合物的质量也需要增加1/2,第二组中实际参加反应的混合物是13.8克,故D错误;
故答案为D
本题难度:一般