1、选择题 在某种一元强酸HA的溶液中加入一种碱MOH,反应后溶液呈中性。下列判断正确的是…()
A.加入的碱过量
B.混合前,在酸与碱中溶质的物质的量相等
C.生成的盐不发生水解
D.反应后溶液中A-和M+的物质的量浓度相等
参考答案:D
本题解析:碱MOH可能为NaOH也可能为NH3·H2O,故A、C错。至于B,若为NaOH则对,若为?NH3·H2O,则错。选项D用电荷守恒,c(M+)+c(H+)=c(A-)+c(OH-),c(M+)=c(A-)。
本题难度:简单
2、填空题 (共13分)
(1)、(2分)物质的量浓度均为0.1 mol/L的下列溶液: ①KNO3、 ②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦NH4Cl,pH 由大到小的顺序为(填序号)?
(2)、(2分)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是?________??
(3)、下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性(9分)
K 2CO3??溶液呈?性;
Na2SO4??溶液呈?性;
CuCl2?溶液呈?性;
参考答案:

本题解析:略
本题难度:简单
3、选择题 物质的量相同的下列溶液中,含粒子种类最多的是()
A.CuSO4
B.Mg(NO3)2
C.KH2PO4
D.NaCl
参考答案:C
本题解析:KH2PO4====K++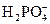
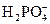 +H2O====H3PO4+OH-,
+H2O====H3PO4+OH-,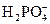
 H++
H++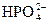
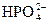
 H++
H++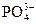
本题难度:简单
4、选择题 常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L
参考答案:C
本题解析:等体积混合后,溶液的溶质应该为NaY,浓度应该为0.15mol/L,但是最后溶液显碱性,说明发生了水解。A选项错误,由pH值计算得到氢离子的浓度为1×10-9 mol/L,则氢氧根离子的浓度应该为1×10-5 mol/L。B选项由于NaY发生水解,则c(Y-)<c(Na+),错误。C选项正确,此等式为质子守恒。D选项最后溶液体积为原来的两倍,钠离子的浓度应该是原来的一半,则为0.15mol/L。
点评:本题涉及到了一个难点知识盐类的水解,学生在做题时经常会遇到的问题有离子浓度大小的判断,盐类水解中的三个守恒关系的判定,这些需要学生多加练习,熟能生巧。
本题难度:一般
5、选择题 已知常温下0.1 mol·L-1的二元酸H2A溶液的pH=4.0。在标准状况下,将2.24 L H2A气体通入到100 mL 1.5 mol·L-1NaOH溶液中,充分反应后(假设溶液体积不发生变化),下列关系式不正确的是(?)
A.c(Na+)+c(H+)= 2c(A2-)+c(OH-)+c(HA-)
B.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
C.c(Na+)>c(HA-)>c(A2-)>c(OH-)>c(H+)
D.c(A2-)+c(HA-)+c(H2A)="1.0" mol·L-1
参考答案:B
本题解析:略
本题难度:简单