1、选择题 下列溶液中微粒的物质的量浓度关系正确的是(?)
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:C(Na+)+C(H+)+C(NH4+)=C(SO42-)+C(OH-)
B.0.01 mol·L-1NaHCO3溶液中:C(Na+)>C(OH-)>C(HCO3-)>C(H+)
C.Na2CO3溶液中:C(OH-)= C(HCO3-)+2C(H2CO3)+ C(H+)
D.25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa溶液等体积混合,溶液呈酸性:C(Na+)>C(CH3COOH) >C(CH3COO-)>C(H+)>C(OH-)
参考答案:C
本题解析:A.向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性,溶液中应存在c(OH-)=c(H+),根据电荷C(Na+)+C(H+)+C(NH4+)=2C(SO42-)+C(OH-)得:C(Na+)+C(NH4+)=2C(SO42-),A错误;B.HCO3―离子少量水解:C(HCO3-)>C(OH-),故C(Na+)>C(HCO3-)>C(OH-)>C(H+),B错误;C.溶液中存在质子守恒,即c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-),C正确;D.等体积混合后,溶液呈酸性,则说明CH3COOH电离程度大于CH3COO-水解程度,所以c(CH3COO-)>c(Na+),故D不正确,选C。
本题难度:一般
2、选择题 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是
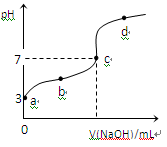
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液c(CH3COO-) > c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中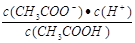 相等
相等
参考答案:C
本题解析:
答案C
恰好完全反应时,产物为CH3COONa,是强碱弱酸盐,水解后溶液呈碱性,pH>7
本题难度:一般
3、选择题 pH=4的NH4Cl溶液和pH=10的Na2CO3溶液中,水的电离度分别为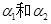 ,则它们的大小关系是
,则它们的大小关系是
A.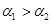
B.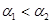
C.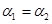
D.无法判断
参考答案:C
本题解析:pH=4的NH4Cl是强酸弱碱盐,水电离的OH-大部分被NH4+消耗生成NH3.H2O,只有
少量水电离的OH-剩余,形成溶液的OH-, 而水电离的H+积累形成溶液的H+,即
[H+]水=[H+]溶液=10-4;而pH=10的Na2CO3是强碱弱酸盐,水电离的H+大部分被CO32-消耗生成HCO3-、H2CO3,只有少量水电离的H+剩余,形成溶液的H+,而水电离的OH-积累形成溶液的OH-,即[OH-]水=[OH-]溶液,又因为[H+]溶液=10-10,所以,[OH-]溶液=10-4,即[OH-]水=10-4。又因为[H+]水=[OH-]水,所以,两者水的解离度相等。
点评:本题考查盐对水电离的影响,在对水电离因素的影响中,要重点掌握酸碱抑制水的电
离,盐要具体问题具体分析。
本题难度:简单
4、选择题 下列浓度关系正确的是
A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+)
B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-)
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+)
D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3)
参考答案:C
本题解析:A.向0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全时发生反应:NH4HSO4+Ba(OH)2=BaSO4↓+NH3·H2O+H2O。NH3·H2O NH4++ OH- ?H2O
NH4++ OH- ?H2O H++ OH-。c (OH-)>c (NH4+)>c (SO42-)>c (H+)。错误。B.根据电荷守恒可得:c (K+)+c (H+)=2c (CO32-)+c (HCO3-)+c (OH-).错误。C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,则发生反应:NaOH+ HCN="NaCN+" H2O。反应后溶液为NaCN 和HCN等物质的量的混合溶液。由于所得溶液呈碱性,说明NaCN的水解作用大于HCN的电离作用,所以个微粒的大小关系为:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+)。正确。D.NaOH溶液电离使溶液显碱性;CH3COONa溶液、Na2CO3溶液、NaHCO3水解使溶液显碱性。由于酸性CH3COOH> H2CO3> HCO3-。酸越强,盐水解的程度就越小。当溶液的pH相同时,盐的浓度就越大。故各物质的浓度的关系是:c (NaOH)<c (Na2CO3) <c (NaHCO3)<c (CH3COONa)。错误。
H++ OH-。c (OH-)>c (NH4+)>c (SO42-)>c (H+)。错误。B.根据电荷守恒可得:c (K+)+c (H+)=2c (CO32-)+c (HCO3-)+c (OH-).错误。C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,则发生反应:NaOH+ HCN="NaCN+" H2O。反应后溶液为NaCN 和HCN等物质的量的混合溶液。由于所得溶液呈碱性,说明NaCN的水解作用大于HCN的电离作用,所以个微粒的大小关系为:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+)。正确。D.NaOH溶液电离使溶液显碱性;CH3COONa溶液、Na2CO3溶液、NaHCO3水解使溶液显碱性。由于酸性CH3COOH> H2CO3> HCO3-。酸越强,盐水解的程度就越小。当溶液的pH相同时,盐的浓度就越大。故各物质的浓度的关系是:c (NaOH)<c (Na2CO3) <c (NaHCO3)<c (CH3COONa)。错误。
本题难度:一般
5、填空题 在FeCl3溶液中存在着平衡体系:Fe3++3H2O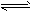 Fe(OH)3+3H+,改变条件,填写下表。(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)
Fe(OH)3+3H+,改变条件,填写下表。(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)

参考答案:
本题解析:
本题难度:一般