1、选择题 常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示
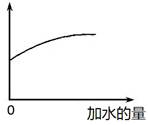
A.CO32-水解的平衡常数
B.溶液的pH
C.溶液中HCO3-的数目
D.溶液中的c(CO32-)
参考答案:C
本题解析:碳酸钠溶于水CO32-水解CO32-+H2O HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
本题难度:一般
2、选择题 下列溶液常温下跟镁反应生成氢气的是……( )
A.NaOH
B.NH4Cl
C.HNO3
D.Na2CO3
参考答案:B
本题解析:A、不反应。
B、在NH4Cl溶液中存在:NH4++H2O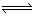 NH3·H2O+H+
NH3·H2O+H+
Mg+2H+=Mg2++H2↑
C、能反应但不产生氢气。
D、不能反应。
本题难度:一般
3、选择题 下列叙述正确的是:?
A.0.1 mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.室温下,Na2CO3溶液加水稀释后, pH和Kw均减小
C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
参考答案:C
本题解析:A 错误,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B 错误,Kw只与温度有关,温度不变,Kw不变
C 正确,在Na2S溶液中加入AgCl固体,会得到硫化银沉淀,c(S2-)下降
D 错误,PH相同,c(H+)相等,都等于10-5mol/L
本题难度:一般
4、填空题 (1)用热水配制AlCl3溶液,会出现浑浊现象,原因是(用离子方程式和必要的文字说明):
?。要消除浑浊现象,又不污染药品,可加入适量的__________溶液。
(2)常温下,有①0.01 mol/L HCl溶液;②pH=12的氨水,其中水的电离程度①?②,(选填“>”、“<”或“=”);若将①、②混合后所得溶液pH=7,则消耗溶液的体积:①?②(选填“>”、“<”或“=”)。若用①来滴定未知浓度的氨水,通常选用____________作指示剂,达滴定终点时各离子浓度由大到小的顺序是_________________________________。
(3)某温度(T℃)时,测得0.01 mol·L-1NaOH溶液的pH=11,则在该温度下,将100 mL 0.2 mol·L-1的稀盐酸与100 mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH=?。
参考答案:(1)Al3++3H2O 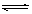 ?Al(OH)3+3H+由于加热会促进Al3+的水解,同时产生的HCl受热逸出,故用热水配制时水解产生的Al(OH)3增多会出现浑浊现象(3分)
?Al(OH)3+3H+由于加热会促进Al3+的水解,同时产生的HCl受热逸出,故用热水配制时水解产生的Al(OH)3增多会出现浑浊现象(3分)
HCl(1分)?
(2)=(2分)?>(2分)甲基橙(2分)c(Cl-)>c(NH4+)>c(H+)>c(OH-)?(2分)
(3)pH=12(2分)
本题解析:(1)原因:铝离子水解,Al3++3H2O Al(OH)3↓+3H+ 温度升高,Al3+水解程度增大,要消除浑浊现象,又不污染药品,可加入适量的盐酸,抑制Al3+水解。
Al(OH)3↓+3H+ 温度升高,Al3+水解程度增大,要消除浑浊现象,又不污染药品,可加入适量的盐酸,抑制Al3+水解。
(2)水的电离程度①=②,因为溶液中c(H+)=c(OH-)
若将①、②混合后所得溶液pH=7,则消耗溶液的体积:①>②,因为氨水的浓度大于盐酸的浓度,盐酸体积应该多些。
若用①来滴定未知浓度的氨水,通常选用甲基橙作指示剂,因为滴定终点显酸性
达滴定终点时各离子浓度由大到小的顺序是:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(3)pH=12
本题难度:一般
5、选择题 常温下,关于下列各溶液的叙述正确的是
A.pH=7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+)
B.0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b
C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)]
D.已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)]
参考答案:C
本题解析: A、醋酸钠与醋酸混合溶液中电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因pH=7,所以c(CH3COO-)=c(Na+),错误;B、醋酸溶液浓度越大,电离度越小,所以a+1>b,错误;C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-)、物料守恒式为c(CH3COO-)+c(CH3COOH)=c(Na+)。其中c(Na+)=2c(Cl-),将电荷守恒式乘以2与物料守恒式相加得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),正确;D、NaF和CH3COOK溶液中电荷守恒式分别为c(Na+)+c(H+)=c(F-)+c(OH-)、c(K+)+c(H+)=c(CH3COO-)+c(OH-),因两溶液pH相等,所以c(H+)和c(OH-)分别相等,所以[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)],错误。
本题难度:困难