1、选择题 为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验,其中合理、可靠的是( )
A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物
C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物
D.测定SbCl3、SbCl5、SnCl4的水溶液的导电性,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
参考答案:B
本题解析:离子化合物形成的晶体都是离子晶体,熔沸点高,所以A不正确,B正确。共价化合物溶于水也能发生电离,也可以导电,但熔融时只有离子化合物可以导电,所以CD都是错误错误的,答案选B。
本题难度:一般
2、简答题 下列化学用语书写正确的是( )
A.NH3分子的结构式:
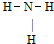
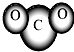
B.CO2分子模型的示意图:
C.乙烯分子的结构简式:CH2CH2
D.Na2O的电子式:
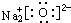
参考答案:A、NH3分子中氮原子最外层5各电子,有三个单电子,与氢原子结合时形成三个共价键,故A正确;
B、二氧化碳分子结构是直线型,选项中的模型中原子的相对位置不对,故B错误;
C、乙烯分子的结构简式中的双键不能省略,故C错误;
D、氧化钠是由钠离子和氧离子构成,电子式的书写两个钠离子不能合并,选项中的电子式不能正确表述得失电子关系,故D错误;
故选A.
本题解析:
本题难度:一般
3、填空题 X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体。含U的化合物的焰色为紫色。试回答下列问题:
(1)U单质的原子堆积方式为?,Y的简单氢化物分子式为?。
(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为________。
(3)化合物甲由Z、U两元素组成,其晶胞如图所示。
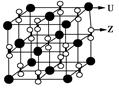
①甲的化学式为______________。
②下列有关该晶体的说法中正确的是________(选填选项字母)。
A.每个晶胞中含有14个U+ 和13个Z2-
B.晶体中每个U+ 周围距离U+ 最近的Z2-?有6个
C.该晶体属于离子晶体
③甲的密度为a g·cm-3,则晶胞的体积是________________cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
参考答案:(1)体心立方堆积 ;? NH3;?(2)5∶1;
(3)①KO2 ;?②BC ;?③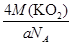 (或
(或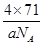 或
或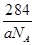 )
)
本题解析:X、Y、Z、U为原子序数依次增大的前四周期元素,基态Y原子的2p轨道处于半充满状态,则外围排布为2s22p3,因此Y为氮元素;X、Y、Z三种元素位于同一周期,且XZ2与Y2Z互为等电子体,因此符合条件的化合物只能是CO2与N2O,故X为碳元素、Z为氧元素;含U的化合物的焰色为紫色,则U为钾元素。
(1)U为钾元素,K单质的原子堆积方式为体心立方堆积;N元素的简单氢化物分子式为NH3。
(2)X为碳元素,一种氢化物的相对分子质量为28,则该氢化物为C2H4,分子中含有1个碳碳双键、4个C-H。碳碳双键含有1个σ键、1个π键,单键都为σ键,因此C2H4分子中σ键与π键的键数之比为5:1。
(3)化合物甲由Z、U两元素组成,其晶胞如图所示。
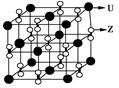
①由晶胞结构并依据均摊法可知,晶胞中K原子数目=8×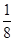 +6×
+6×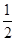 =4。O原子数目=2×12×
=4。O原子数目=2×12×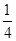 +2=8,故K原子与O原子数目之比为4:8=1:2,所以甲的化学式为KO2。
+2=8,故K原子与O原子数目之比为4:8=1:2,所以甲的化学式为KO2。
②A、由①中计算可知,每个晶胞中含有4个K+和4O2-,故A错误;B、由晶胞结构可知,晶体中每个K+周围距离K+最近的O2-有6个(即上下、左右和前后个1个),故B正确;C、该晶体由K+和O2-构成,属于离子晶体,故C正确,答案选BC。
③晶胞含有4个钾离子,则晶胞的质量=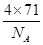 g,因为甲的密度为a?g?cm-3,所以晶胞的体积=
g,因为甲的密度为a?g?cm-3,所以晶胞的体积=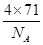 g÷ag?cm-3=
g÷ag?cm-3=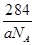 cm3。
cm3。
本题难度:一般
4、选择题 已知磷酸分子结构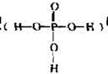 ?中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
?中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是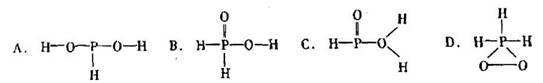
参考答案:B
本题解析:因为次磷酸能发生氢交换,说明次磷酸里面含羟基,但次磷酸钠不能发生氢交换,说明里面不再有羟基了,由此可以得出次磷酸中只含有一个羟基,选B。
本题难度:一般
5、简答题 Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大.W、X与Y同周期,Y与Z同主族.Q与W可以按照原子个数比4:1形成化合物甲,且甲分子中含有10个电子.Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2:1反应形成盐丙.
(1)请写出甲的结构式______.
(2)请写出Q和Y形成的既含极性键又含非极性键的共价化合物的化学式______
(3)丙属于______化合物(共价或离子),向少量丙溶液中加入浓NaOH溶液加热,反应的离子方程式是______.
参考答案:短周期元素Q和W按照原子个数比4:1形成10个电子的化合物,可推知甲为CH4,则Q为氢元素,W为碳元素;
因W、X、Y同为第二周期,且Y与Z同主族,故Z为非金属元素,Z的最高价氧化物对应水化物为酸,该酸能与乙(X的氢化物)按1:2发生反应生成盐,该氢化物一定为NH3,而该酸一定为二元酸,即Z为硫元素,Y为氧元素.
(1)甲为CH4,结构式为
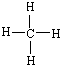
,故答案为:

;
(2)Q为氢元素,Y为氧元素,形成的既含极性键又含非极性键的共价化合物为过氧化氢,化学式为H2O2,故答案为:H2O2;
(3)乙为NH3,Z的最高价氧化物的水化物为H2SO4,两者按照物质的量之比2:1反应形成(NH4)2SO4,故丙为(NH4)2SO4,是离子化合物,向少量丙溶液中加入浓NaOH溶液加热,发生反应离子方程式为NH4++OH-?△?.?NH3↑+H2O,故答案为:离子;NH4++OH-?△?.?NH3↑+H2O.
本题解析:
本题难度:一般