| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《能量的相互转化》试题巩固(2020年最新版)(二)
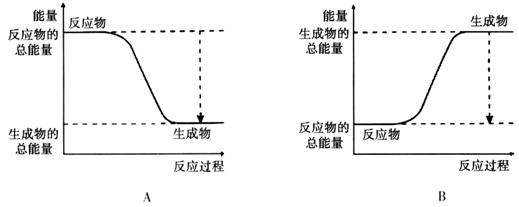 (3)从断键和成键的角度分析上述反应中能量的变化。已知:化学键的键能:?
(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为? (5)氢氧燃料电池的总反应方程式为 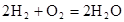 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。参考答案:(1)? ABC?(2)A?(3)484KJ 本题解析:(1)A. 使用催化剂可以大大加快正反应速率。正确。B. 因为氧气是反应物。提高氧气的浓度,及增大反应物的浓度,可以加快化学反应速率。正确。正确。C. 提高反应的温度。可以加快化学反应速率。正确。D. 降低反应的温度,减慢化学反应速率。错误。(2)由于已知该反应为放热反应。则反应物的能量高于生成物的能量,在发生反应时多余的能量释放出来。图像应该为A。(3)断裂化学键吸收能量,形成化学键释放能量,反应过程中的能量变化就是二者的差值,所以2molH2在氧气中燃烧生成气态水放出的热量是2mol×436kJ/mol+1mol×496 kJ/mol-4mol×463 kJ/mol=484KJ.即氧气中燃烧生成气态水的热反应方程式为2H2 (g)+ O2(g)=2H2O(g)。ΔH=-484KJ/mol. (4)因为1克氢气完全燃烧生成液态水放出QKJ的热量,所以氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+ O2(g)=2H2O(l)? △H=-4QKJ/mol。(5)在氢氧燃料电池中通入氢气的电极为负极,负极发生氧化反应,n(e-)=0.2mol。则n(H2)=0.1mol. 在标准状况下消耗H2的体积是V=0.1mol×22.4L/mol=2.24L. 本题难度:一般 3、填空题 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g) 参考答案:(1)△H=反应物吸收的能量-生成物放出的能量═-E3kJ/mol=-(E2-E1)kJ/mol, 本题解析: 本题难度:一般 4、选择题 在容积固定不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是 |
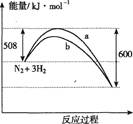
参考答案:BD
本题解析:A、没有标注各物质的聚集状态,错误;B、达到平衡后向容器中通入1 mol氦气,容器体积固定,与反应相关的物质,浓度不变,平衡不移动,正确;C、平衡常数的影响因素为温度,缩小容器体积,平衡常数不变,错误;D、催化剂能降低反应活化能,正确。
本题难度:一般
5、填空题 (8分)(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是?(填“吸热”或“放热”)反应,NO2和CO的总能量?(填“>”、“<”或“=”)CO2和NO的总能量。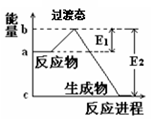
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:
NO2+CO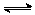 CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速为?。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为?。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是?
A.容器内气体的质量保持变
B.NO2的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变
D.NO2的消耗速率与CO2的消耗速率相等
E.容器内气体的物质的量保持不变
参考答案:(8分)(1)放热(1分)、>(1分)、0.05mol/(L·min)(2分)、1.5mol(2分)、BD(2分)
本题解析:(1)根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应,因此NO2和CO的总能量>CO2和NO的总能量。
(2)①容器中NO的物质的量为0.2 mol,则根据方程式可知,生成CO2的物质的量也是0.2mol,所以该段时间内,用CO2表示的平均反应速为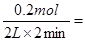 0.05mol/(L·min)。
0.05mol/(L·min)。
根据化学方程式可知,反应前后气体的体积是不变的,所以反应后气体的总的物质的量仍然是0.5mol+1mol=1.5mol。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B正确;根据质量守恒定律可知,容器内气体的质量是不变的,所以A不正确;根据方程式可知,反应前后气体的体积是不变的,所以容器内气体的物质的量保持不变,则E不能说明;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,在反应过程中质量和气体的物质的量是不变的,C不能说明;D中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,所以正确的答案选BD。
点评:判断化学平衡状态的标志有:(1)任何情况下均可作为标志的:①υ正=υ逆(同一种物质);②各组分含量(百分含量、物质的量、质量)不随时间变化;③某反应物的消耗(生成)速率、某生成物的消耗(生成)速率=化学计量数之比;(2)在一定条件下可作为标志的是:①对于有色物质参加或生成的可逆反应体系,颜色不再变化;②对于有气态物质参加或生成的可逆反应体系,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容);③对于恒温绝热体系,体系的温度不在变化;(3)不能作为判断标志的是:①各物质的物质的量或浓度变化或反应速率之比=化学计量数之比 (任何情况下均适用);②有气态物质参加或生成的反应,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《阿伏伽德罗.. | |