| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《能量的相互转化》试题巩固(2020年最新版)(四)
 N2(g)+CO2(g) ? N2(g)+CO2(g) ? H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下: H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K=? (保留两位小数)。 ⑦前10min内用v(NO)表示的化学反应速率为?,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是??。 ③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a ?0(填“>”、“=”或“<”)。 Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。 (1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示 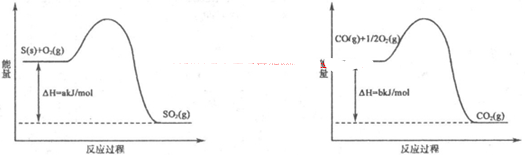 则用SO2除去CO的热化学方程式为?。 (2)高温时,也可以用CO还原MgSO4可制备高纯MgO。 ①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是??。 ②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ?,该电池总反应的离子方程式为?。 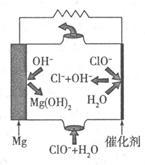 参考答案:I(1)B?(2)① 0.25?② 0.0042mol?L-1?min-1,降低CO2浓度 ③ < 本题解析:I(1)该反应的平衡常数已经很大了,所以提高尾气净化效率关键是加快反应速率。A、因为该反应为可逆反应,所以装有尾气净化装置的汽车排出的气体中仍然含有NO或CO,错误;B、使用高效催化剂可以加快反应速率,所以提高尾气净化效率的最佳途径是使用高效催化剂,正确;C、增大压强,汽车尾气的排放很难做到,错误;D、升高温度,汽车尾气的排放很难做到,错误。 本题难度:困难 4、选择题 氢化热是指一定条件下,1 mol 不饱和化合物加氢时放出的热量。表中是环己烯(
根据表中数据推断正确的是 A.环己二烯与H2的反应最剧烈 B.环己烯、环己二烯和苯有相同的官能团 C.三种化合物中环己二烯的稳定性最强 D.上述条件下,1 mol  转变为 转变为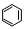 时放热 时放热参考答案:D 本题解析:A.通过氢化热只能判断反应热的变化情况无法判断其反应剧烈程度,错误。B.环己烯、环己二烯都在碳碳双键,而苯中没有,故没有相同的官能团,错误。C.根据能量越低物质越稳定,苯是最稳定的,错误。D正确。 本题难度:一般 5、填空题 写出下列反应的热化学方程式: 参考答案:(4分,每小题2分) 本题解析:(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ,那么2mol乙烷(C2H6)气体完全燃烧生成液态水放出热量3120kJ,故乙烷燃烧的化学方程式为2C2H6(g) + 7O2(g) = 4CO2(g) + 6H20(l) △H=-3120kJ/mol。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《阿伏伽德罗.. | |