1、填空题 已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子 数的2倍。
数的2倍。 试回答:
试回答:
(1) 写出下列元素的元素符号:X_________、Y_________、Z_________、 W_________。
W_________。
(2 这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式为?。
(3) 将9g单质Y在足量W单质中燃烧,所得气体通入1L 1mol·L-1 NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为?g。
参考答案: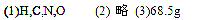
本题解析:略
本题难度:简单
2、选择题 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4︰3,? Z原子比X原子的核外电子数多4。下列说法正确的是 (?)?
A.W、Y、Z的氢化物稳定性顺序可能是W>Z>Y
B.W、X、Y、Z的原子半径大小顺序Z<Y<X<W
C.Z的氧化物对应水化物的酸性一定强于W氧化物对应水化物的酸性
D.Z的某种氧化物可以做新型消毒剂
参考答案:D
本题解析:由短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4︰3可知W为C、X为Al,Z原子比X原子的核外电子数多4,可知Z为Cl,Y的原子序数应大于13,小于17,。A、W、Y、Z的氢化物稳定性:Z的最稳定,错误;B、W、X、Y、Z的原子半径大小顺序W< Z<Y<X<,错误;C、应是Z的最高价氧化物对应水化物的酸性一定强于W氧化物对应水化物的酸性,错误;D、ClO2可以做新型消毒剂,正确。
本题难度:一般
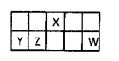
3、填空题 I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:
(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明W非金属性强于Z: _______________(用化学方程式表示)。
(3)含Y的某种盐常用作净水剂,其净水原理是__________(用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________。
(5)已知:①C(s)+ O2(g)=CO2(g)?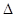 H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)
H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g) 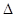 H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?
H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?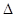 H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
(6)已知:CO(g)+H2O(g) H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的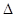 H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
参考答案:(1)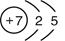 (2分)(2)2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(3分)
(2分)(2)2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(3分)
(3)Al3++3H2O Al(OH)3+3H+(2分)(4)Si-4e-+6OH-=SiO32-+3H2O(3分)
Al(OH)3+3H+(2分)(4)Si-4e-+6OH-=SiO32-+3H2O(3分)
(5)2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1(3分) (6)<(1分)? 75%(3分)
本题解析:根据短周期元素X、Y、Z、W在元素周期表中相对位置可知,X位于第二周期,Y、Z、W位于第三周期。其中Y所处的周期序数与族序数相等,所以Y是第三周期第ⅢA族元素,即Y是铝,则Z是Si,X是N,W是Cl。
(1)氮元素的原子序数是7,则氮元素的原子结构示意图为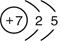 。
。
(2)判断非金属性强弱的一般规律是:①由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。②由单质和酸或者和水的反应程度判断:反应越剧烈,非金属性越强。③由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。④由和氢气化合的难易程度判断:化合越容易,非金属性越强。⑤由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强。(除氟元素之外)。⑥由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。⑦由置换反应判断:强置弱。〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕。⑧按元素周期律,同周期元素由左到右,随核电荷数的增加,非金属性增强;同主族元素由上到下,随核电荷数的增加,非金属性减弱。⑨非金属单质与具有可变价金属的反应。能生成高价金属化合物的,其非金属性强。因此可以根据高氯酸能制备硅酸来验证W非金属性强于Z,反应的化学方程式为2HClO4+Na2SiO3=2NaClO4+H2SiO3↓。
(3)明矾溶于水电离出的铝离子水解生成氢氧化铝胶体,胶体具有吸附性,因此明矾可以作净水剂,反应的离子方程式为Al3++3H2O Al(OH)3+3H+。
Al(OH)3+3H+。
(4)原电池中负极失去电子,发生氧化反应。所以根据反应式Si+2NaOH+H2O=Na2SiO3+2H2可知,如果利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),则硅是负极,因此该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O。
(5)已知:①C(s)+ O2(g)=CO2(g)?△H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g) △H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?△H=c kJ· mol-1,则根据盖斯定律可知①+②-③即得到工业上生产粗硅的热化学方程式,即为2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1。
(6)根据表中数据可知,随着温度的升高,平衡常数逐渐减小。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0;设CO和H2O起始浓度分别为a,则
CO(g)+H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始浓度? a? a? 0? 0
转化浓度? b? b? b? b
平衡浓度? a-b? a-b? b? b
所以根据平衡常数表达式可知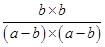 =9
=9
解得b=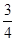 a
a
所以CO平衡转化率为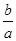 ×100%=75%
×100%=75%
本题难度:困难
4、选择题 下列离子中外层d轨道达全充满状态的是 (? ? )
? )
A? Cu+?B? Fe3+?C? Co3+?D? Cr3+ ?
参考答案:A
本题解析:略
本题难度:一般
5、填空题 (15分)A、B、C、D、E、F六种元素分布在三个不同的短周期,他们的原子序数依次增大,其中 B与C为同一周期,A 与D,C与F分别在同一主族 ,A、D两元素原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,请回答下列问题:
(1)由A、B两种元素可以组成B2A4型化合物,该化合物中存在的共价键类型为是?。写出该化合物的电子式?
(2)E 是非金属元素,但能表现出一些金属元素的性质,写出E与D元素的最高价氧化物的水化物反应的离子方程式?。
(3)等浓度的ABC2溶液、HClO溶液、盐酸溶液,其导电能力:盐酸溶液>ABC2溶液>HClO溶液,则溶液的 pH (DBC2 )?pH(DClO)(填“>、<、=”)理由是?(用离子方程式解释)
(4)现有100.00mL 未知浓度的ABC2溶液,用?(仪器名称)量取10.00mL待测溶液于锥形瓶中,加入几滴?(可选指示剂:酚酞、石蕊、甲基橙),用A、C、 D三种元素组成的浓度为0.10mol/L的标准溶液来测定未知浓度的ABC2溶液,判断滴定终点的现象是?;记录消耗标准溶液的体积为12.00mL,则该ABC2溶液的浓度为mol/L;
参考答案:(1)?极性和非极性? (2分) ?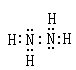 ?(2分)
?(2分)
(2)? Si + 2OH- + H2O = SiO32- + 2H2 (2分)?
(3)? < (1分)? NO2- + H2O?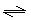 ?HNO2 +OH-?, ClO- + H2O?
?HNO2 +OH-?, ClO- + H2O?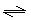 ?HClO + OH-后者水解程度大于前者(3分)
?HClO + OH-后者水解程度大于前者(3分)
(4) 酸式滴定管(1分) , 酚酞(1分) , 溶液由无色变粉红色半分钟不褪色(1分),
0.12 (2分)
本题解析:略
本题难度:一般