1、填空题 (10分)现有部分短周期元素的性质或原子结构如下表:
元素编号
| 元素性质或原子结构
|
T
| M层上有2对成对电子
|
X
| 基态原子核外电子共占据5个原子轨道且有2个未成对电子,
|
Y
| 常温下单质为双原子分子,其氢化物水溶液呈碱性
|
Z
| 元素最高正价是+7价
|
(1)元素T的原子最外层共有________种不同运动状态的电子。
(2) 元素Z与元素T相比,非金属性较强的是________(用元素符号表示),
(3)下列表述中能证明“元素Z与元素T相比,非金属性较强的”这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)元素X和元素Y的第一电离能的大小关系为_________,请说明理由_______________。
(5)CO和Y2是等电子体,CO和Y2的结构均可表示为A≡B的形式(A、B可表示相同元素的原子也可表示不同元素的原子)。下表是两者的键能数据:(单位:kJ/mol)
?
| A-B
| A=B
| A≡B
|
CO
| 357.7
| 798.9
| 1071.9
|
Y2
| 154.8
| 418.4
| 941.7
|
结合数据说明CO比Y2活泼的原因:______________________________________。
2、选择题 短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是(?)
?
A.X位于元素周期表中第三周期第VIA族
B.Z元素的气态氢化物为极性分子
C.Y元素最高价氧化物对应水化物为强酸
D.五种元素中原子半径最大的是R
3、选择题 在目前的长式周期表中,同一主族的两种元素原子的核外电子数的差值可能为(?)
A.6
B.12
C.26
D.30
4、选择题 已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。请回答下列问题:
(1)Z基态原子的核外电子排布式是?;
(2)X、Y可组成一化合物,其原子个数之比为5:1。其化学式中含有的化学键有?。
(3)YX3分子的空间构型是?,中心原子的杂化方式是?;Y的氢化物的沸点比W的氢化物的沸点?(填“高”或“低”)。
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z 2W2的电子式为?。
5、选择题 a、b、c、d是四种短周期的主族元素。a、b、d同周期,其中d的质子数最大;a、c同主族。a的原子结构示意图为: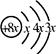 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: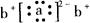 。
。
下列叙述正确的是(?)
A.原子半径:a>c>d
B.相应氢化物的沸点:d>c>a
C.非金属性:c>a>d
D.c与a、c与b均能形成两种常见化合物