1、填空题 (15分)下图为中学化学中几种常见物质之间的转化关系。已知:(1)A、C、D是常见的气体单质,(2)F气体极易溶于水,且液态常用做制冷剂。(3)G为易溶性的盐,E为白色沉淀。(4)H为无色液体化合物。
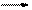
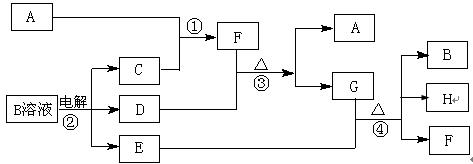 (1)写出G的电子式?,
(1)写出G的电子式?,
(2)鉴定G中阳离子的实验方法和现象___________________________?_;
(3)反应②的离子方程式?。
(4)反应③的化学方程式?。
(5)将等物质的量的F与G溶于水,所得溶液pH>7,则该溶液中各种离子浓度大小顺序为:?。
参考答案:(每空3分,共15分)(1)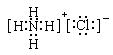 ;
;
(2)取少量D的溶液加人试管中,用胶头滴管加入少量NaOH浓溶液,加热,用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色
(3)Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑
Mg(OH)2↓+H2↑+Cl2↑
(4)8NH3 + 3Cl2 N2 + 6NH4Cl?(5)c(NH4+)>c(Cl-)>c(OH-)>c(H+)
N2 + 6NH4Cl?(5)c(NH4+)>c(Cl-)>c(OH-)>c(H+)
本题解析:略
本题难度:一般
2、实验题 A~K为中学化学常见的物质,它们之间的转化关系如下图,部分生成物和反应条件等省略。已知C、D是由元素X、Y、Z中的两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。请回答下列问题:
1)写出A的化学式______________。
(2)比较Y与Z的原子半径大小:_________>_______(填写元素符号)。
(3)检验L溶液中金属阳离子的方法是__________________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式
________________________________________________________
参考答案:(1)CuCO3或Cu2(OH)2CO3或Cu(OH)2·CuCO3;
(2)C>O
(3)取少量L溶液于试管,滴加KSCN溶液,如溶液呈血红色,证明溶液含Fe3+
(或其他合理答案)
(4)3Cu2O+14HNO3 6Cu(NO3)2+2NO↑+7H2O(方程式3分,其他每空2分)
6Cu(NO3)2+2NO↑+7H2O(方程式3分,其他每空2分)
本题解析:本题的关键是综合题目所给信息,判定各物质的化学式
依据G为氯气、I有漂白作用可初步判定C+G→H+I的反应可能是:Cl2+H2O=HCl+HClO;
盐酸与金属J生成的浅绿色溶液只能是FeCl2溶液:Fe+2HCl=FeCl2+H2↑;FeCl2被氯气氧化为棕黄色溶液L:FeCl3;而反应①是常用于制作印刷电路板,则知道M为铜,即:Cu+2FeCl3=2FeCl2+CuCl2;生成的B溶液CuCl2与NaOH生成Cu(OH)2与葡萄糖生成砖红色的F :Cu2O
A与盐酸生成CuCl2、水及D物质:X元素为H,与氧元素组成了C,也就是水;由Y、Z原子最外层电子数之和为10,可判定另一元素的最外层电子数为4,且可与氢元素形成无色且不可燃烧的气体D,也只能是CO2气体,所以Y、Z元素分别为C、O;
所以A为碳酸盐、铜盐,与盐酸生成了CuCl2、H2O及CO2,故A可能是CuCO3或Cu2(OH)2CO3
(2)同周期自左向右,原子半径逐渐减小
(3)考查铁离子的检验
(4)考查Cu2O与硝酸反应的方程式的书写及配平
本题难度:一般
3、填空题 (11分)A、B、C、D、E五种物质的转化关系如下图所示:
 ?
?
(1)确定A、B、C、D、E各为什么物质:
A、_________, B、__
B、__ _______,C、_________,D、_________,E、_________。
_______,C、_________,D、_________,E、_________。
(2)写出下列各步反应的化学方程式:
C→D:_____________________________________________;
E→C:_____________________________________________;
C→A:_____________________________________________。
参考答案:(1)A:Cu? B:CuCl2固体 C:CuCl2溶液 D:Cu(OH)2? E:CuO?(每空1分)
(2)C→D:
E→C: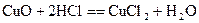
C→A: (每空2分)
(每空2分)
本题解析:略
本题难度:一般
4、填空题 X,Y,Z,W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y﹑W均相邻,Y﹑Z和W三种元素的原子最外层电子数之和为17,且Z﹑W最外层电子数相同则:(每小题2分,共4分)
(1)?用电子式表示X与Y所组成化合物的形成过程?
(2)?W在周期表中的位置是?
(3)?已知,在101kPa时,X单质在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,则表示X单质燃烧热的热化学方程式为__________。
参考答案:(1)?略?
(2)?第三周期,VIA族
(3)??H2(g)+1/2O2(g)="1/2H2O(l);?" △H =285.8KJ/mol
本题解析:略
本题难度:一般
5、选择题 (17分)A、B、C、D、E五种元素原子序数依次增大,除E外均为短周期主族元素,B、C、D同周期,A、D同主族。A的最外层有三个未成对的电子,B是同周期第一电离能最小的元素,C的原子结构示意图为:?,E的价层电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _______? B_______? C _______? D _______
(2)用元素符号表示A、C、D电负性由小到大的顺序____________。
(3)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是_____。
(4) D的氢化物比A的氢化物的沸点_____(填"高"或"低"),A的氢化物分子立体构型为________。
(5) E元素在周期表的位置是______________。
(6) B、C、D最高价氧化物的晶体类型是分别是______、________、______。
参考答案:(1) N? Na ?Si?P?(2) Si<P<N?(3) HNO3?(4) 低,三角锥形?
(5)第四周期VIII族?(6)离子晶体、原子晶体、分子晶体
本题解析:考查元素原子的电子排布规律即元素周期表和元素周期律。
(1)C的原子结构示意图为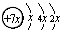 ,所以x=2,即C是硅元素。B、C、D同周期,A、D同主族,因此A是第二周期元素。A的最外层有三个未成对的电子,所以A是氮元素,则D是磷元素。金属性越强,电离能越小,所以B是第三周期的钠元素。根据E的价层电子排布式3d64s2并结合构造原理可得出E是铁元素。
,所以x=2,即C是硅元素。B、C、D同周期,A、D同主族,因此A是第二周期元素。A的最外层有三个未成对的电子,所以A是氮元素,则D是磷元素。金属性越强,电离能越小,所以B是第三周期的钠元素。根据E的价层电子排布式3d64s2并结合构造原理可得出E是铁元素。
(2)非金属性越强,电负性越大,非金属性是Si<P<N,则电负性也Si<P<N。
(3)非金属性越强,最高价氧化物对应水化物的酸性越强。
(4)氨气中存在氢键,所以其沸点高于PH3的。
(5)铁属于第四周期第VIII族。
(6)B、C、D最高价氧化物分别是Na2O、SiO2、P2O5,其晶体类型分别是离子晶体、原子晶体、分子晶体。
本题难度:一般